
某学习小组针对如何测定镀锌铁皮镀锌层厚度提出如下一些方案:
方案1.将一定质量的镀锌铁皮投入到足量的盐酸中,使其完全溶解,通过测量氢气的体积,计算铁皮上的锌的质量。
方案2.将一定质量的镀锌铁皮(W1)投入到足量的FeSO4溶液中,一段时间后,取出铁片,洗净、烘干、称量(W2),计算铁皮上的锌的质量。
方案3.将一定质量的镀锌铁皮投入到足量的盐酸中,使其完全溶解,再在所得溶液中加入过量的NaOH溶液,过滤、洗涤、烘干、灼烧、沉淀,最后称量。
……
(1)方案2的主要特点是__________,
方案3的主要缺点是__________。
(2)方案1中用到测量气体体积的装置,如图装置中不能用于测量气体体积的装置是 。
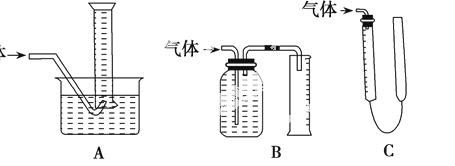
学习小组拟选用C装置作量气装置,则气体收集完毕,准备读数时,应注意:____________。
科目:高中化学 来源: 题型:
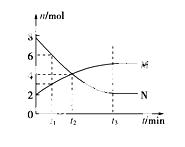 在一定温度下,容器内某一反应中,M、N的物质的量随反应时间变化的曲线如下图,下列表述正确的是( )
在一定温度下,容器内某一反应中,M、N的物质的量随反应时间变化的曲线如下图,下列表述正确的是( )
A.反应的化学方程式为2M N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)
 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
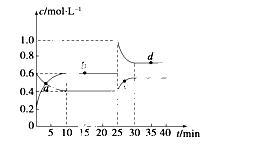
(1)该温度下,该反应的平衡常数为______________,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为____________。
(3)25 min时,加入了__________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度________(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气净化中的一个反应如
下:

在一容积为5L的恒容密闭容器中充人0.2 mol NO和0.5mol CO,5 min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
min后该反应达到平衡,此时N2的物质的量为0.06mol。下列说法正确的是
A.达到平衡后,若只升高温度,化学平衡正向移动
B.达到平衡后,再通人稀有气体,逆反应速率增大
C.使用催化剂,平衡常数不变
D.0~5 min内,NO的反应速率为2.4×1 0-3 mol·L一1·min一1
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g) 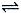 B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
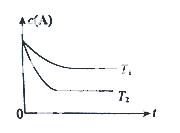 (1)上述反应的温度T1 T2,平衡常数K(T1) K(T2)。(填“大于”、“小于” 或“等于”)
(1)上述反应的温度T1 T2,平衡常数K(T1) K(T2)。(填“大于”、“小于” 或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为 。
②反应的平衡常数K= 。
③反应在0~5min区间的平均反应速率v(A)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5 mol·L-1 MgSO4溶液和0.5 mol·L-1 NH4HCO3溶液。
步骤2:用量筒量取500 mL NH4HCO3溶液于1 000 mL四口烧瓶中,开启搅拌器,温度控制在50 ℃。
步骤3:将250 mL MgSO4溶液逐滴加入NH4HCO3溶液中,1 min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1 h后,过滤,洗涤。
步骤5:在40 ℃的真空干燥箱中干燥10 h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
回答下列问题:
①步骤3中加氨水后的离子方程式______________________
____________________________________________________。
②步骤4为加快过滤速度,常用____________________ (填过滤方法)。
(2)测定合成的MgCO3·nH2O中的n值。
称量1.000 g碳酸镁晶须,放入下图所示的广口瓶中,加入适量水,滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5 h,反应后期将温度升到30 ℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。
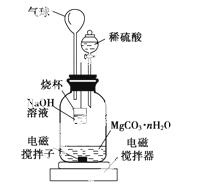
①图中气球的作用是____________________。
②上述反应后期要升温到30 ℃,主要目的是______________。
③设3次实验测得每1.000 g碳酸镁晶须产生的CO2平均值为a mol,则n值为____________________(用含a的表达式表示)。
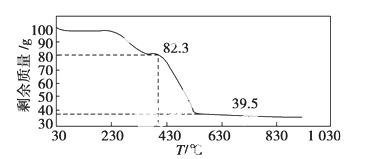
(3)称取100 g上述晶须产品进行热重分析,热重曲线如下图。则该条件下合成的晶须中,n=____________(选填:1、2、3、4、5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
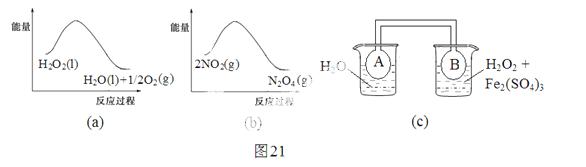
H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。限选试剂与仪器:30% H2O2、0.1mol∙L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:__ __________
__________
②设计实验方案:在不同H2O2浓度下,测定 ____________________________________(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成下图的装置示意图。
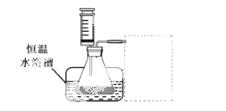
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
(2)利用图21(a)和21(b)中的信息,按图21(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
小明同学在学习“硫酸及其盐的某些性质与用途”的过程中,进行如下实验探究。
[实验一]探究浓硫酸的氧化性,将实验室常用的药品放入如图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
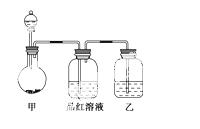
(1)该装置设计上存在明显缺陷,请指出:_______________________________。
(2)写出装置甲中反应的化学方程式:______________________________
__________________。装置乙中的试剂是:_______________________。
[实验二]探究某硫酸亚铁盐固体是否变质
(3)请你帮助小明同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列叙述错误的是( )
A.常温常压下,8.8g CO2和N2O混合气体中所含的电子数为4.4NA
B.5.6 g铁与500 mL 2 mol·L-1硝酸反应,转移的电子数为0.2NA
C.常温常压下,0.4 mol Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
D. V La mol·L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com