
【题目】下列物质在括号内的条件下可以与烷烃发生反应的是
A. 氯水(光照)B. 浓硫酸C. 氧气(点燃)D. 酸性KMnO4溶液
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】按要求书写下列化学方程式:
(1)丙烯的加聚
(2)1,3﹣丁二烯与等物质的量的单质溴在60℃时发生1,4﹣加成
(3)甲苯制备TNT
(4)1,2﹣二溴乙烷与氢氧化钠水溶液共热:
(5)乙醛的还原:
(6)乙二醇和乙二酸脱水成二元环酯 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于下列反应的反应类型的判断,不正确的是 ( )
A. SO3+H2O=H2SO4 化合反应
B. Fe2O3+3CO![]() 2Fe+3CO2 置换反应
2Fe+3CO2 置换反应
C. Cu(OH)2![]() CuO+H2O 分解反应
CuO+H2O 分解反应
D. NaCl +AgNO3=AgCl↓+NaNO3 复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶:“84消毒液”,包装说明如下:
净含量:1000 mL 密度:1.19 g·cm-3
主要成分:25%NaC1O
使用方法:稀释l00倍(体积比)后使用
注意亊项:密封保存,易吸收空气中的CO2变质
请根据以上信息和相关知识判断,下列分析不正确的是
A. 该“84消毒液”的物质的量浓度约为4.0 mol·L-1
B. 一瓶该“84消毒液”中含NaC1O的质量为297.5g
C. 取l00mL该“84消毒液”稀释100倍后用以消毒,稀释后的溶液中c(Na+)约为0.04 mol·L-1
D. 参阅该“84消毒液”的配方,欲用NaClO固体配制25%NaClO的消毐液480 mL,需要称量的NaClO固体质量为I43g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如下图所示,则下列说法中正确的是

A. 投入的Na、K一定等质量 B. 投入的Na的质量大于K的质量
C. 曲线a为K,b为Na D. 稀盐酸的量一定是不足量的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)在一条鱼、虾绝迹的小河边有四座工厂甲、乙、丙、丁(如下图),它们排出的废液里,每个工厂只有Na2CO3、CuCl2、Ca(OH)2、HC1中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈浅蓝色浑浊:③丙处河水由浑变淸:④丁处产生气泡,河水仍淸,请推断:

(1)工厂棑除的废液里含有的污染物:甲_______,乙_____________。
(2)写出④中有关反应的离子方程式___________________。
(II)X、Y、Z三种物质有如下转化关系:

(1)根据上述转化关系,写出下列物质的化学式:X_______、试剂乙________________。
(2)写出③步反应的离子方程式:③___________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消細,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
(1)方法一的离子方程式为______________________________。
(2)方法二中被氧化的物质是_______,若反应中有0.1 mol电子转移,则产生的ClO2气体在标准状况下的体积为_________L。
(3)用双线桥法标出方法一中方程式电子转移的方向和数目_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器中进行SO2的催化氧化反应.若起始时c(SO2)=c(O2)=6mol/L,平衡时测得c(O2)=4.5mol/L,则下列叙述中正确的是( )
A.SO2的转化率为60%
B.SO3的产率为60%
C.平衡时总压强与起始压强之比为7:8
D.平衡时V(SO2):V(O2):V(SO3)=3:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组以粗盐和碳酸氢铵(NH4HCO3)为原料,采用以下流程制备纯碱和氯化铵. 已知盐的热分解温度:NH4HCO3 36℃; NaHCO3 270℃; NH4Cl 340℃; Na2CO3>850℃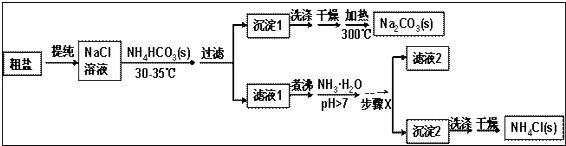
(1)粗盐中含有Ca2+、Mg2+、SO42﹣等杂质离子,使用的试剂有:①NaOH ②BaCl2③HCl ④Na2CO3 , 其加入的顺序合理的是 A.①③④②B.①②④③C.③②④①D.①②③④
过滤中用到玻璃棒的作用是
(2)如何判断粗盐中SO42﹣是否已除尽?;
(3)从NaCl溶液到沉淀1的过程中,需蒸发浓缩.在加入固体NH4HCO3之前进行蒸发浓缩优于在加入NH4HCO3之后,原因是;
(4)写出沉淀1受热分解的化学方程式;
(5)为提高NH4Cl产品的产率和纯度,需在滤液中加入氨水,理由是; 步骤X包括的操作有;
(6)采用“甲醛法”测定工业产品中氯化铵的纯度(假定杂质不与甲醛反应),反应原理为:4NH4Cl+6HCHO→(CH2)6N4+4HCl+6H2O 某技术人员称取1.5g该样品溶于水,加入足量的甲醛并加水配成100mL溶液.从中取出10mL,滴入酚酞再用0.1mol/L的NaOH溶液滴定,到滴定终点时消耗NaOH溶液25.00mL.则该样品中氯化铵的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com