
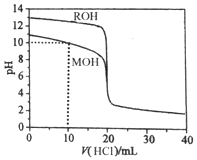
| A. | pH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-) | |
| C. | 10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-) | |
| D. | V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-) |
分析 根据图知,未加HCl溶液时,ROH的pH=13,说明c(OH-)=c(ROH),为强碱;MOH的pH小于13,则MOH为弱碱;
A.MOH溶液中加入10mLHCl溶液时,溶液中的溶质为等物质的量浓度的MOH和MCl,溶液呈碱性,说明MOH电离程度大于MCl水解程度,MOH电离程度较小;
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,ROH已经完全反应,溶液中溶质为等物质的量浓度的MCl、RCl,MCl为强酸弱碱盐,M+水解导致溶液呈酸性,但水解程度较小;
C.10mL<V(HCl)<20mL时,溶液中溶质为MOH和MCl,且c(MCl)>c(MOH),溶液中存在物料守恒;
D.V(HCl)>20mL时,HCl过量导致溶液呈酸性,根据电荷守恒得c(Cl-)>c(M+),溶液中溶质存在有c(MCl)=c(HCl)、c(MCl)>c(HCl)或c(MCl)<c(HCl)三种情况.
解答 解:根据图知,未加HCl溶液时,ROH的pH=13,说明c(OH-)=c(ROH),为强碱;MOH的pH小于13,则MOH为弱碱;
A.MOH溶液中加入10mLHCl溶液时,溶液中的溶质为等物质的量浓度的MOH和MCl,溶液呈碱性,说明MOH电离程度大于MCl水解程度,MOH电离程度较小,氯离子不电离也不水解,所以c(MOH)<c(Cl-),故A错误;
B.将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,ROH已经完全反应,溶液中溶质为等物质的量浓度的MCl、RCl,MCl为强酸弱碱盐,M+水解导致溶液呈酸性,但水解程度较小,R+不水解,所以存在c(R+)>c(M+)>c(H+)>c(OH-),故B正确;
C.10mL<V(HCl)<20mL时,溶液中溶质为MOH和MCl,且c(MCl)>c(MOH),溶液中存在物料守恒c(M+)+c(MOH)>c(Cl-),故C错误;
D.V(HCl)>20mL时,HCl过量导致溶液呈酸性,根据电荷守恒得c(Cl-)>c(M+),溶液中溶质存在有c(MCl)=c(HCl)、c(MCl)>c(HCl)或c(MCl)<c(HCl)三种情况,可能出现c(Cl-)>c(M+)=c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生分析、判断能力,明确各点溶液中溶质成分及其性质是解本题关键,易错选项是D,注意滴加过程中可能出现c(M+)>c(H+)、c(M+)=c(H+)、c(M+)<c(H+)情况,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CO是氧化剂 | B. | CO是还原剂 | ||
| C. | CO既是氧化剂又是还原剂 | D. | CO既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ |
| 0.1mol/LNaOH溶液 | pH=11NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH=3CH3COOH溶液 |
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将④加蒸馏水稀释至原来的100倍时,所得溶液的PH>5 | |
| C. | ①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH) | |
| D. | 等体积等PH的④溶液和盐酸分别与足量的Zn反应,④溶液生成同条件下氢气体积多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
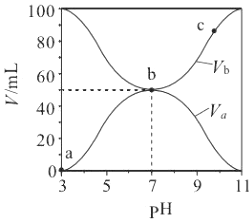
| A. | Ka(HA)的值与 Kb(BOH) 的值不相等 | |
| B. | b 点时,水电离出的 c(H+)=10-7mol/L | |
| C. | c 点时,c(A-)>c(B+) | |
| D. | a→c 过程中$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
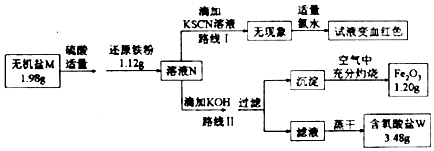
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 分别向2mL0.1mol/LNaHCO3,和2mL0.1mol/LNa2CO3溶液中滴加2mL 0.2mol/L的盐酸 | 盛有NaHCO3溶液试管产生气泡速度快 | 结合H+能力CO32->HCO3- |
| B | 将石蜡油(烷烃)蒸汽通过灼热的碎瓷片,并将产生的气体通人溴的四氯化碳溶液 | 溴的四氯化碳溶液褪色 | 生成气体中含有不饱和烃 |
| C | 向KI溶液中加入淀粉,然后滴入稀硫酸数滴 | 开始无明显现象,片刻溶液变蓝 | 氧化性:H2SO4>I2 |
| D | 向某溶液中加入盐酸 | 产生刺激性气味的气体和黄色沉淀 | 溶液中一定存在S2O32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com