
·ÖĪö ÅØĮņĖįŌöÖŲ10.8gĪŖ·“Ӧɜ³ÉµÄĖ®µÄÖŹĮ棬Ķعż×ĘČČŃõ»ÆĶ£¬ÓÉÓŚ·¢Éś·“Ó¦CuO+CO$\frac{\underline{\;\;”÷\;\;}}{\;}$Cu+CO2£¬¹ĢĢåÖŹĮæ¼õĒįĮĖ3.2g£¬½įŗĻ·½³ĢŹ½ĄūÓĆ²īĮæ·ØæɼĘĖćCOµÄĪļÖŹµÄĮ棬Ķعż¼īŹÆ»ŅŹ±£¬¼īŹÆ»ŅµÄÖŹĮæŌö¼ÓĮĖ17.6gæɼĘĖć×ÜCO2µÄĪļÖŹµÄĮ棬¼õČ„COÓėCuO·“Ӧɜ³ÉµÄCO2µÄÖŹĮæĪŖÓŠ»śĪļČ¼ÉÕÉś³ÉCO2µÄÖŹĮ棬øł¾ŻŌŖĖŲŹŲŗć¼ĘĖćÓŠ»śĪļÖŠŗ¬ÓŠC”¢H”¢OµÄĪļÖŹµÄĮ棬½ų¶ųĒóµĆ»ÆѧŹ½£¬½įŗĻ¶ŌÓ¦µÄŠŌÖŹŗĶ·Ö×ÓČ·¶Øŗ¬ÓŠµÄ¹ŁÄÜĶÅ£¬½ų¶ųČ·¶ØÓŠ»śĪļµÄ½į¹¹¼ņŹ½£®
½ā“š ½ā£ŗ£Ø1£©ÅØĮņĖį¾ßÓŠĪüĖ®ŠŌ£¬ÅØĮņĖįµÄÖŹĮæŌö¼Ó10.8g£¬ĖµĆ÷Éś³ÉĖ®µÄÖŹĮæĪŖ10.8g£¬¹Ź“š°øĪŖ£ŗ10.8g£»
£Ø2£©n£ØH2O£©=$\frac{10.8g}{18g/mol}$=0.6mol£¬n£ØCO2£©=$\frac{26.4g}{44g/mol}$=0.6mol£¬·¢Éś·“Ó¦CuO+CO$\frac{\underline{\;\;”÷\;\;}}{\;}$Cu+CO2£¬¹ĢĢåÖŹĮæ¼õĒįĮĖ3.2g£¬¼õÉŁµÄÖŹĮæĪŖOŌŖĖŲµÄÖŹĮ棬æÉÖŖn£ØCO£©=$\frac{4.8g}{16g/mol}$=0.3mol£¬ŌņÓŠ»śĪļŗĶ0.55mol O2ŌŚĆܱÕČŻĘ÷ÖŠČ¼ÉÕÉś³Én£ØCO2£©=0.6mol-0.3mol=0.3mol£¬ÓÉÖŹĮæŹŲŗćæÉÖŖÓŠ»śĪļŗ¬ÓŠµÄn£ØO£©=£Ø0.6mol+0.3mol+0.3mol”Į2£©-0.55mol”Į2=0.4mol£¬Ōņ1molÓŠ»śĪļŗ¬ÓŠN£ØC£©=$\frac{0.6}{0.2}$=2£¬N£ØH£©=$\frac{0.6”Į2}{0.2}$=6£¬N£ØO£©=$\frac{0.4}{0.2}$=2£¬Ōņ·Ö×ÓŹ½ĪŖC3H6O2£¬
¹Ź“š°øĪŖ£ŗC3H6O2£»
£Ø3£©ČōøĆÓŠ»śĪļÄÜÓėĢ¼ĖįÄĘ·“Ó¦£¬ĖµĆ÷ŗ¬ÓŠōČ»ł£¬Ó¦ĪŖCH3CH2COOH£¬¹Ź“š°øĪŖ£ŗCH3CH2COOH£»
£Ø4£©ČōøĆÓŠ»śĪļ³ŹÖŠŠŌĒŅÄÜĖ®½ā£¬Ņ²ÄÜ·¢ÉśŅų¾µ·“Ó¦£¬ĖµĆ÷Ó¦ĪŖ¼×ĖįŅŅõ„£¬¹Ź“š°øĪŖ£ŗ¼×ĖįŅŅõ„£»
£Ø5£©ÄÜ·¢ÉśŅų¾µ·“Ó¦£¬ÓÖÄÜÓė½šŹōÄĘ²śÉśĒāĘų£¬ĖµĆ÷ŗ¬ÓŠČ©»łŗĶōĒ»ł£¬Ó¦ĪŖCH3CHOHCHO»ņCH2OHCH2CHO£¬¹²2ÖÖ£¬¹Ź“š°øĪŖ£ŗ2£®
µćĘĄ ±¾Ģāæ¼²éĄūÓĆČ¼ÉÕ·ØČ·¶ØÓŠ»śĪļ·Ö×ÓŹ½”¢ÓŠ»śĪļ½į¹¹µÄÅŠ¶Ļ”¢¹ŁÄÜĶŵĊŌÖŹµČ£¬ĪŖøßæ¼³£¼ūĢāŠĶŗĶøßĘµæ¼µć£¬²ąÖŲæ¼²éѧɜµÄ·ÖĪö”¢¼ĘĖćÄÜĮ¦£¬ĢāÄæÄѶČÖŠµČ£¬×¢ŅāÕĘĪÕŌ×ÓŹŲŗćÅŠ¶ĻÓŠ»śĪļµÄ·Ö×ÓŹ½·½·Ø£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| »ÆѧŹ½ | H2£Øg£© | CO£Øg£© | CH3OH£Øl£© |
| ±ź×¼Č¼ÉÕČČ£Ø25”ę£© ”÷H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
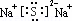
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 5ÖÖ | B£® | 4ÖÖ | C£® | 3ÖÖ | D£® | 2ÖÖ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĻČ¼ÓNaOH£¬ŗó¼ÓNa2CO3£¬ŌŁ¼ÓBaCl2 | B£® | ĻČ¼ÓNaOH£¬ŗó¼ÓBaCl2£¬ŌŁ¼ÓNa2CO3 | ||
| C£® | ĻČ¼ÓNa2CO3£¬ŗó¼ÓBaCl2£¬ŌŁ¼ÓNaOH | D£® | ŅŌÉĻ“š°ø½ŌæÉ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŹµŃéŹŅÅäÖʵÄŃĒĢśŃĪČÜŅŗŌŚæÕĘųÖŠ±»Ńõ»Æ£ŗ4Fe2++O2+2H2OØT4Fe3++4OH- | |
| B£® | ŅŌ½šŹōŅųĪŖŃō¼«µē½ā±„ŗĶĮņĖįĶČÜŅŗ£ŗCu2++2H2O$\frac{\underline{\;Ķصē\;}}{\;}$2Cu+O2”ü+4H+ | |
| C£® | Ca£ØClO£©2ČÜŅŗÖŠĶØČė¹żĮæµÄSO2ĘųĢå£ŗClO-+SO2+H2OØTHClO+HSO3- | |
| D£® | ÓĆĖį»ÆµÄøßĆĢĖį¼ŲČÜŅŗŃõ»ÆĖ«ŃõĖ®£ŗ2 MnO4-+6H++5H2O2ØT2Mn2++5O2”ü+8H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĪĀ¶Č | B£® | Ń¹Ēæ | C£® | ÅØ¶Č | D£® | “߻ƼĮ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1 mol•L-1 | B£® | 1.5 mol•L-1 | C£® | 2 mol•L-1 | D£® | 2.5 mol•L-1 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com