
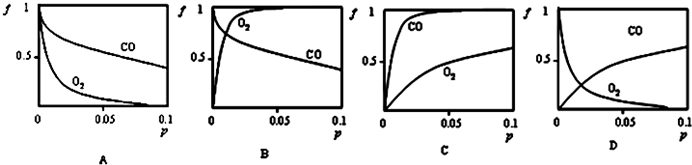
���� ��1��Mb��aq��+X��g��?MbX��aq��������ѹǿ��ƽ�������ƶ������������CO����O2������ѹǿ��������ʣ�f�������������쵰����CO��Ϸ�Ӧ��ƽ�ⳣ��K��CO��Զ������O2��ϵ�ƽ�ⳣ��K��O2����˵�����쵰����CO�Ľ������������O2�Ľ������ǿ��
��2������ƽ��ʱ����С���ӵļ��쵰�ף�MbX����Ũ��Ϊ[MbX]�����쵰�ף�Mb����Ũ��Ϊ[Mb]������K�ĸ���������ʽ��
����Mb��ʼŨ��Ϊ1����������ʽ��
Mb��aq��+O2��g��?MbO2��aq��
��ʼ��1 0
ת������ ��
ƽ�⣺1-�� ��
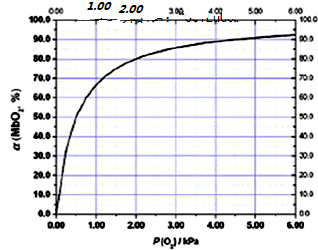
K=$\frac{c��Mb{O}_{2}��}{c��Mb��•P��{O}_{2}��}$=$\frac{��}{��1-����P��{O}_{2}��}$������ͼ2��p��O2��=2.0kPa����=80%��������㣻
��3����I��Hb��aq��+H+��aq��?HbH+��aq����H1
II��HbH+��aq��+O2��g��?HbO2��aq��+H+��aq����H2
III��Hb��aq��+O2��g��?HbO2��aq������H3
���ݸ�˹���ɢ�+��=��ɵã�
�ڸ��ݷ�Ӧ�Է����е��ж����ݡ�G=��H-T��S��0ʱ�Է����У���H��0����S��0��ʱ�������Է���Ӧ��
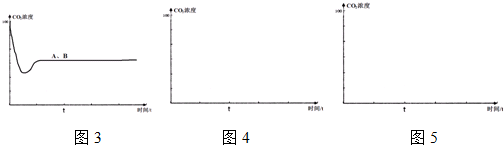
��4��ͼ3Ϊ�¶ȼ��������£�øʧȥ���ԣ�A��B�ķ�Ӧ���ʼ�����ͬ�����ʼ��죬��Ӧʱ��С��t������Ӧ�Ƚ�С��ͼ�ٿ���Ϊ�����¶��µķ�Ӧͼ��ø���Խ�ǿ����������A��B��Ӧ���ʲ��죬��Ӧʱ��ӽ�t����Ӧ�����У�ͼ�ڿ���Ϊ�����µķ�Ӧͼ��ø���Ժ�������Ӧ���ʺ�������Ӧʱ�����t������Ӧ�Ⱥܴ�
��� ��1������Mb��aq��+X��g��?MbX��aq��������ѹǿ��ƽ�������ƶ������������CO����O2������ѹǿ��������ʣ�f�������������ڳ����£����쵰����CO��Ϸ�Ӧ��ƽ�ⳣ��K��CO��Զ������O2��ϵ�ƽ�ⳣ��K��O2����˵�����쵰����CO�Ľ������������O2�Ľ������ǿ��������ͬѹǿ�����£����쵰����CO�Ľ���ʣ�f���������Cͼ����ϣ�
�ʴ�Ϊ��C��
��2������ƽ��ʱ����С���ӵļ��쵰�ף�MbX����Ũ��Ϊ[MbX]�����쵰�ף�Mb����Ũ��Ϊ[Mb]�������Mb��aq��+X��g��?MbX��aq����ƽ�ⳣ��K=$\frac{[MbX]}{[Mb]•\frac{p}{p0}}$������[Mb]=$\frac{[MbX]}{K•\frac{p}{p0}}$����������С���ӵļ��쵰�ף�MbX��ռ�ܼ��쵰�ı���Ϊ$\frac{[MbX]}{[MbX]+[Mb]}$����[Mb]���������ɵã�����Ϊ$\frac{pK}{pK+p0}$��
�ʴ�Ϊ��$\frac{pK}{{pK+{P_0}}}$��
����Mb��ʼŨ��Ϊ1����������ʽ��
Mb��aq��+O2��g��?MbO2��aq��
��ʼ��1 0
ת������ ��
ƽ�⣺1-�� ��
K=$\frac{c��Mb{O}_{2}��}{c��Mb��•p��{O}_{2}��}$=$\frac{��}{��1-����•p��{O}_{2}��}$������ͼ2��p��O2��=2.0kPa����=80%��K=$\frac{0.8}{��1-0.8����2}$=2.00��
�ʴ�Ϊ��2.00��
��3����I��Hb��aq��+H+��aq��?HbH+��aq����H1
II��HbH+��aq��+O2��g��?HbO2��aq��+H+��aq����H2
III��Hb��aq��+O2��g��?HbO2��aq������H3
���ݸ�˹���ɢ�+��ɵâ����H3=��H1+��H2��
�ʴ�Ϊ����H1+��H2��
�ڡ�G=��H-T��S��0ʱ��Ӧ�Է����У���H��0����S��0ʱ����������£���G��0�Է����У�
�ʴ�Ϊ����������
��4������ͼ3Ϊ�¶ȼ��������£�øʧȥ���ԣ�A��B�ķ�Ӧ���ʼ�����ͬ�����ʼ��죬��Ӧʱ��С��t������Ӧ�Ƚ�С��ͼ4����Ϊ�����¶��µķ�Ӧͼ��ø���Խ�ǿ����������A��B��Ӧ���ʲ��죬��Ӧʱ��ӽ�t����Ӧ�����У�ͼ5����Ϊ�����µķ�Ӧͼ��ø���Ժ�������Ӧ���ʺ�������Ӧʱ�����t������Ӧ�Ⱥܴ�
�ʴ�Ϊ��ͼ4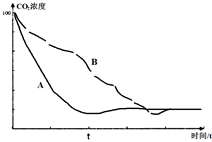 ��ͼ5
��ͼ5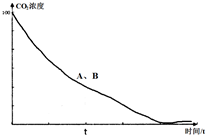 ��
��
���� ���⿼�컯ѧ��Ӧԭ��������һ�Ĺ�ҵ�ϳɵĹ�����������������������뵰��ϵ�ƽ��ģ�ͣ��dz���ӱ�������˼ά�����ܸߣ�������Ҳ��С���ر��ǵڣ�2����Ҫ���ƽ�ⳣ��������ʽ�������գ���������ƽ���ѹ����ʵ���չ���ڣ�4���⿼��ѧ���������ۡ�ȫ��˼���������������ѶȺܴ�


 һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д� Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 +
+ ��
��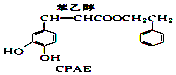 +H2O��
+H2O��| A�� | 1molCPAE��1mol������ֱ���������NaOH��Һ��Ӧ�����������3molNaOH | |
| B�� | �뱽�Ҵ���Ϊͬ���칹��ķ������ʹ���9�� | |
| C�� | FeCl3��Һ���������CPAE | |
| D�� | ������ɷ����ۺϷ�Ӧ������������к���3�ֹ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������£�HD�ܻ�ԭ����ͭ | |
| B�� | HD����������ȼ������HCl��DCl���� | |
| C�� | ��һ�ַǽ������� | |
| D�� | ��һ�ֻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
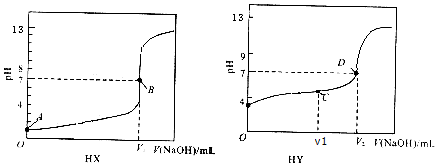
| A�� | V1=20mL��V2��20mL | |
| B�� | A��֮����B��֮ǰ����Һ�У�һ���ǣ�c��X- ����c�� Na+����c��H+����c��OH- �� | |
| C�� | ��V1=10mL��C�����Һ�У�һ���ǣ�c��HY ��-c�� Y-��=2[c��OH- ��-c��H+��] | |
| D�� | D���Ժ����Һ�У�һ���ǣ�c�� Na+����c��OH- ����c��Y- ����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������Ƿdz���Ҫ�Ļ�ѧԭ�ϣ���Ҫ����������������˿���ٺϽ������Ʒ������ұ�������У����������Ƽ��������Ƽ�����Һ�еõ�����ƣ�������Ӧ��
������Ƿdz���Ҫ�Ļ�ѧԭ�ϣ���Ҫ����������������˿���ٺϽ������Ʒ������ұ�������У����������Ƽ��������Ƽ�����Һ�еõ�����ƣ�������Ӧ��| �¶�/�� | 25 | 50 | 90 | 100 |
| K1 | 79.96 | 208.06 | 222.88 | 258.05 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
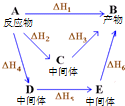
| A�� | ���ΪC4H8�Ļ��������ʶ���ͬ | |
| B�� | �ⵯԭ��D��T������${\;}_1^1$H�ڻ�ѧ��Ӧ����ȡ | |
| C�� | ��ͭ��⾫��ʱ���������ٵ�����һ�������������ӵ����� | |
| D�� | ͼ������A����ͬ;������Bʱ���ʱ����㣺��H1=��H2+��H3=��H4+��H5+��H6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
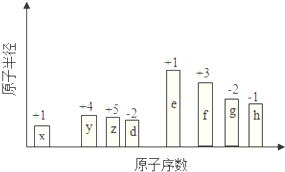 ��ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸX��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ��
��ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸX��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ��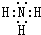 ��λ�ڵ�����������zͬ�����Ԫ�أ�����̬�⻯��Ļ�ѧʽΪAsH3��
��λ�ڵ�����������zͬ�����Ԫ�أ�����̬�⻯��Ļ�ѧʽΪAsH3���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
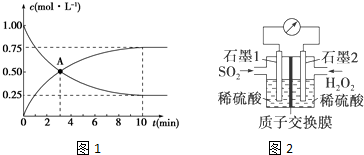
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com