
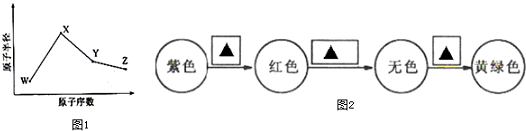
分析 W、X、Y、Z是四种常见的短周期元素,W的最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的高纯度单质广泛应用于信息材料中,原子序数大于Na,故Y为Si;Z的非金属性在同周期主族元素中最强,则Z为第ⅤⅡA族元素,原子序数大于Si,所以Z为Cl元素,据此解答.
解答 解:W、X、Y、Z是四种常见的短周期元素,W的最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,故W为O元素;X和Ne原子的核外电子数相差1,且原子半径大于氧,所以X为Na元素;Y的高纯度单质广泛应用于信息材料中,原子序数大于Na,故Y为Si;Z的非金属性在同周期主族元素中最强,则Z为第ⅤⅡA族元素,原子序数大于Si,所以Z为Cl元素.
(1)X为Na,在周期表中的位置:第三周期IA族,X的最高价氧化物对应的水化物的化学式为NaOH,
故答案为:第三周期IA族;NaOH;
(2)将氯气通入石蕊溶液中,氯气与水存在平衡Cl2+H2O?HClO+HCl,H+使紫色石蕊溶液变红色,HClO具有漂白性,又使溶液红色褪去,Cl2使溶液呈黄绿色,
故答案为:H+;HClO;Cl2;
(3)用焦炭和SiO2反应可制的Si的单质,反应方程式为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
点评 本题考查位置结构性质关系应用,推断元素是解题关键,注意掌握新制氯水成分与性质,有利于学生对基础知识的巩固,难度不大.


科目:高中化学 来源: 题型:解答题
 )是一种环保型的新涂料,其合成路线如下图所示:
)是一种环保型的新涂料,其合成路线如下图所示:
 ,E是高分子化台物,其结构简式为
,E是高分子化台物,其结构简式为 ;
; $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O;
+H2O; (写出其中一种的结构简式).
(写出其中一种的结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要在室内放一盆水 | |
| B. | 向地势低的地方撤离 | |
| C. | 观察风向,顺风撤离 | |
| D. | 用湿毛巾或蘸有弱碱性溶液的毛巾捂住口鼻撤离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、MnO4-、Na+、Cl- | B. | Fe3+、Na+、Cl-、SO42- | ||
| C. | NH4+、Na+、NO3-、CO32- | D. | Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制品的耐腐蚀性强,说明铝的化学性质不活泼 | |
| B. | 铁板上镀锡属于电化学防护 | |
| C. | 生铁中含有碳,抗腐蚀能力比纯铁强 | |
| D. | 将海水中的钢铁闸门与电源的负极相连,可防止闸门被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极发生还原反应,电极反应式包括:Cu2++2e-═Cu,Ni2++2e-═Ni | |
| B. | 电解过程中,阳极减少的质量可能等于阴极增加的质量 | |
| C. | 电解后,电解槽底部的阳极泥中含有Cu、Pb和Pt | |
| D. | 若不考虑阳离子的水解,则电解过程中电解质溶液中的金属阳离子的总数目不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com