
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在水溶液中: H+、I―、NO3―、SiO32-
B.水溶液中:Cl-、NO3-、Na+、SO32-
C.将足量CO2通入时:H+、NH4+、AlO2-、SO42-
D.碱性溶液中:NO3-、I-、Na+、Al3+
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年上海市五校高三上学期联合教学质量调研化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1 mol甲苯含有C—H键数目为8NA
B.1 mol丙烯酸中含有双键的数目为NA
C.由a g C2H4和C3H6组成的混合物中所含共用电子对数目为3aNA/14
D.在过氧化钠跟水的反应中,每生成2.24 L氧气,转移电子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三上学期阶段四考试化学试卷(解析版) 题型:选择题
下列有关物质性质的应用正确的是
A.液氨汽化时要吸收大量的热,可用作制冷剂
B.SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.氯化铝是一种电解质,可用于电解制铝
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一12月月考化学试卷(解析版) 题型:填空题
(20分)某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:

已知:Si+2NaOH+ H2O =Na2 Si O3+2H2↑,H2Si O3是不溶于水的弱酸。
(1)固体A的成分是:____________,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)步骤④中,用到的仪器有三脚架、酒精灯以及
(4)在空气中将NaOH溶液滴入FeCl2溶液中,观察到的现象是 ,反应的化学方程式是 ,
(5)该样品中铝的质量分数是:_______________________________(用a、b表示)。
(6)下列因操作不当,会使测定结果偏大的是___________
A.第①步中加入NaOH溶液不足 B.第②步中加入盐酸不足时
C.第④步中的沉淀未用蒸馏水洗涤 D.第④步对沉淀灼烧不充分
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一12月月考化学试卷(解析版) 题型:选择题
对Fe、Al2O3、SiO2、NaClO、NaAlO2的分类正确的是
A.能与碱反应的物质是Al2O3、SiO2 B.能与盐酸反应的物质是Fe、Al2O3、SiO2
C.能与水反应的物质是Fe、Al2O3 D.具有两性的物质是Al2O3、SiO2、NaAlO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高一12月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.被氧化的物质是氧化剂
B.可以利用酒精将碘水中的碘提取出来
C.化合反应一定不是氧化还原反应
D.铝抗腐蚀是外层氧化膜致密的缘故
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:填空题
有下列各组微粒或物质
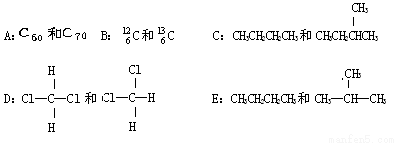
① 组两种微粒互为同位素;② 组两种物质互为同素异形体;
③ 组两种物质属于同系物;④ 组两物质互为同分异构体;
⑤ 组两物质是同一物质。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高一上学期期末化学试卷(解析版) 题型:选择题
下列各对物质中,互为同系物的是
A.CH4、C2H4 B.CH4、C2H5OH
C.C2H6、C3H8 D.CH3COOH、C3H8
查看答案和解析>>
科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高三上学期期中考试化学试卷(解析版) 题型:填空题
(18分)(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)向移动;溶液中 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_____________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com