
【题目】铅酸蓄电池是常见的化学电源,其电极材料分别是Pb和PbO2,电解质溶液为一定浓度的硫酸。充放电的总反应是: Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O

(1)该蓄电池放电工作时电解质溶液中SO42-移向________(填“正极”或“负极”,下同)充电时,该极接直流电源的_________。
(2)Cu2O是一种半导体材料,可通过右图的电解装置制取,电解总反应为:2Cu+H2O![]() Cu2O+H2↑
Cu2O+H2↑
阴极的电极反应式是__________________________。 若用铅酸蓄电池作为电源进行电解,当蓄电池中有0.2mol H+被消耗时,Cu2O的理论产量为_______g。
(3)为防止钢闸门在水中被腐蚀,可将其与铅酸蓄电池的_______极相连(填Pb或PbO2)。
(4)用铅蓄电池电解500mL饱和食盐水(足量)。电解一段时间后,共收集到气体1120mL(已折算成标准状况下),则所得溶液的pH=_________(不考虑气体的溶解及电解前后溶液体积的变化)
【答案】 负极 负极 2H++2e-=H2↑ 7.2 Pb 13
【解析】(1)放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,故SO42-移向负极;充电时,该极接直流电源的负极;(2)在电解池中,阴极是阳离子氢离子发生得电子得还原反应,即2H++2e-=H2↑;根据电子守恒,当蓄电池中有0.2mol H+被消耗时,转移电子是0.2mol,当转移0.2mol电子时,根据电解反应:2Cu+H2O![]() Cu2O+H2↑,Cu2O的生成量为0.05mol,质量为7.2g;(3)为防止钢闸门在水中被腐蚀,利用外加电源的阴极保护法,则可将其与铅酸蓄电池的负极Pb极相连;(4)根据电极反应方程式
Cu2O+H2↑,Cu2O的生成量为0.05mol,质量为7.2g;(3)为防止钢闸门在水中被腐蚀,利用外加电源的阴极保护法,则可将其与铅酸蓄电池的负极Pb极相连;(4)根据电极反应方程式![]() 可知,电解一段时间后,共收集到标准状况下气体1120mL,则所得溶液的n(OH-)=
可知,电解一段时间后,共收集到标准状况下气体1120mL,则所得溶液的n(OH-)=![]() ,c(OH-)=
,c(OH-)= ![]() ,pH=13。
,pH=13。


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】工业上常用水蒸气蒸馏的方法(蒸馏装置如图)从植物组织中获取挥发性成分。这些挥发性成分的混合物统称精油,大都具有令人愉快的香味。从柠檬、橙子和柚子等水果的果皮中提取的精油90%以上是柠檬烯(柠檬烯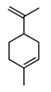 )。提取柠檬烯的实验操作步骤如下:
)。提取柠檬烯的实验操作步骤如下:
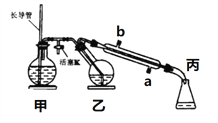
(1)将1~2个橙子皮剪成细碎的碎片,投入乙装置中,加入约30 mL水
(2)松开活塞K。加热水蒸气发生器至水沸腾,活塞K的支管口有大量水蒸气冒出时旋紧,打开冷凝水,水蒸气蒸馏即开始进行,可观察到在馏出液的水面上有一层很薄的油层。
下列说法不正确的是( )
A. 当馏出液无明显油珠,澄清透明时,说明蒸馏完成
B. 蒸馏结束后,为防止倒吸,立即停止加热
C. 长玻管作安全管,平衡气压,防止由于导管堵塞引起爆炸
D. 要得到纯精油,还需要用到以下分离提纯方法:萃取、分液、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.2 mol/L的一元碱BOH与等浓度盐酸等体积混合后,所得溶液中部分微粒组分及浓度如图所示。下列说法正确的是( )
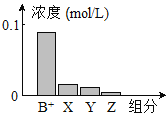
A.BOH为强碱
B.该混合液pH=7
C.该混合溶液中:c(B+)+c(Y)=c(Cl-)
D.图中X表示BOH,Y表示H+,Z表示OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下。该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法正确的是
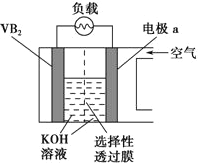
A. 电极a为电池负极
B. 反应过程中溶液的pH升高
C. 电池连续反应过程中,选择性透过膜采用阳离子选择性膜
D. VB2极的电极反应式为:2VB2+ 22OH-22e=V2O5+ 2B2O3+ 11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al、Fe、Cu 是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)基态Fe2+的核外电子排布式为[Ar]______,有__个未成对电子。
(2)氯化铝熔点为194℃,而氧化铝熔点为2050℃,二者熔点相差很大的原因是_____。
(3)已知Al 的第一电离能为578kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因________。
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是____;SiO2中Si原子采取____杂化。
(5)一种铜的溴化物晶胞结构如图所示:该晶胞中铜的配位数是___,与溴紧邻的溴原子数目是________,由图中P点和Q点的原子坐标参数可确定R点的原子坐标参数为________;已知晶胞参数为apm,其密度为_______g/cm3 (列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×102 Ka2=6.2×108 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=________mol·L1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH![]() 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的c(![]() )/c(
)/c(![]() )=_________________。
)=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验装置,测定葡萄糖还原新制氢氧化铜所得红色物质的组成。下列说法中正确的是
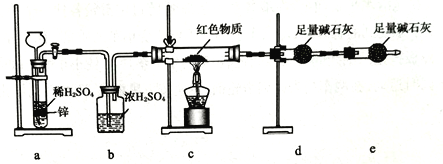
A. 将装置a中的Zn换成CaCO3也可制备CO2气体
B. 若撤去b装置,则会导致该物质含氧量测定结果偏低
C. 只需称量装置d反应前后的质量就可确定该物质的组成
D. 装置e的作用是防止空气中的H2O、CO2等进入装置d中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验: ①0.1molL﹣1AgNO3溶液和0.1molL﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加几滴0.1molL﹣1KI溶液,出现浑浊;
③向沉淀c中滴加几滴0.1molL﹣1KI溶液,沉淀变为黄色.
下列分析不正确的是
A. 浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl﹣(aq)
Ag+(aq)+Cl﹣(aq)
B. ③中颜色变化说明AgCl转化为AgI
C. 实验可以证明AgI比AgCl更难溶
D. 滤液b中不含有Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。

已知:溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨饱和溶液中c(OH-)约为1×10-3 mol·L-1。
(1)写出A与氢氧化钠溶液反应的化学方程式:______________。
(2)上述流程中两次使用试剂①,推测试剂①应该是________ (填字母)。
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(3)H中溶质是________。
(4)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是_______的化学式
(5)计算溶液F中的c(Mg2+)=___________________(25 ℃时,氢氧化镁的Ksp=5.6×10-12)。
II.某化学兴趣小组用下图所示装置进行电化学原理的实验探究.
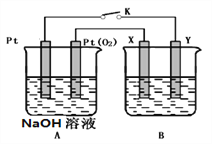
(1)A装置为乙醇燃料电池,若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为___________。
(2)若B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,X、Y皆为惰性电极,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时B电池溶液的pH=_______,要使该溶液恢复到原来的状态,需加入___________(填物质并注明物质的量)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com