
分析 根据价层电子对互斥理论确定离子空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数根据其价层电子对数,当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化,根据杂化确定VSEPR模型,采用sp杂化,为直线形结构,sp2杂化,无孤电子对数,空间构型是平面三角形,含1对孤电子对,分子立体构型为V形,采用sp3杂化,含孤电子对数为0,形状为正四面体形,含有一个孤电子对,空间构型为三角锥型,n=6,sp3d2杂化,含有2个孤电子对,分子立体结构为平面正方形.
解答 解:H3O+中氧原子价层电子对个数=3+$\frac{6-2×1-2}{2}$=4,采用sp3杂化,含有3个共价单键和一个孤电子对,所以H3O+的离子立体结构为三角锥型,
氯化硼中硼原子价层电子对个数=3+$\frac{3-3}{2}$=3,采用sp2杂化,含有3个共价单键且不含孤电子对,所以BCl3的构型为平面三角形;
XeF4价层电子数:8+4×1=12,XeF4中氙原子价层电子对个数=4+$\frac{8-4}{2}$=6,所以需要6条轨道,判断出Xe为sp3d2杂化,但因为Xe-F键只有4个,即只占用4条轨道,所以还有2条轨道被孤对电子占据,所以分子立体结构为平面正方形,
故答案为:三角锥型;平面三角形;平面正方形.
点评 本题考查了原子杂化方式及分子或离子的立体构型的判断,侧重分子或离子结构与性质的考查,注意杂化轨道理论的理解应用,把握常见分子或离子中原子的杂化及空间构型为解答的关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将40 g NaOH固体溶解于1 L水中 | |
| B. | 将22.4 L氯化氢气体溶于水配成l L溶液 | |
| C. | 将l L 10 mol/L的浓盐酸与9 L水混合 | |
| D. | 20 g NaOH固体溶解在水中配成500 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-4b kJ/mol | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-2b kJ/mol | |
| C. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2b kJ/mol | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-b kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PCl3→PCl5 | B. | MnO4-→Mn2+ | C. | SO2→SO32- | D. | FeCl3→FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
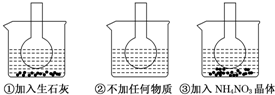
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见氧化物,气体E是单质F所含元素的氢化物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
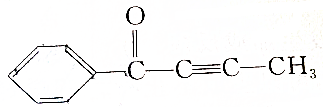 ,请回答下列问题:
,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加强汽车治理和垃圾处理场的建设和监管 | |
| B. | 实施“煤改气”、“煤改电”等清洁能源改造工程 | |
| C. | 研制新型高效可充电电池,发展纯电动汽车 | |
| D. | 加高工厂的烟囱,使烟尘和废气远离地表 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com