
| A. | 12C和13C为不同核素 | B. | 金刚石和C60互为同素异形体 | ||
| C. | 1H2和2H2互为同位素 | D. | 氧原子(18O)的结构示意图为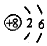 |
分析 A.二者的中子数不同,为碳元素的不同核素;
B.同种元素形成的不同单质互为同素异形体;
C.同位素的研究对象为原子,1H2和2H2为氢气分子;
D.氧原子的核电荷数=核外电子总数=8,最外层含有6个电子.
解答 解:A.12C和13C的质子数相同、中子数不同,属于碳元素的不同核素,故A正确;
B.金刚石和C60为碳元素的不同单质,二者互为同素异形体,故B正确;
C.1H2和2H2都是氢气分子,而同位素研究对象为原子,二者不属于同位素,故C错误;
D.氧原子(18O)的核电荷数、核外电子总数都是8,最外层电子数为6,其原子结构示意图为: ,故D正确;
,故D正确;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及原子结构示意图、元素符号、核素、同素异形体等知识,明确同位素、同素异形体的概念为解答关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题
 甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途.
甲醚作为一种基本化工原料,由于其良好的易压缩、冷凝、汽化特性,使甲醚在制药、燃料、农药等化学工业中有许多独特的用途.| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.8 | 1.24 | ? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4 s时c(B)为0.38 mol/L | |
| B. | 830℃达平衡时,A的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①②③ | C. | ②③⑤ | D. | ①②⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
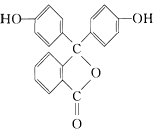
| A. | 1mol酚酞最多与2molNaOH发生中和反应 | |
| B. | 酚酞分子中所有碳原子不可能共平面 | |
| C. | 酚酞结构中有三个苯环,属于芳香烃 | |
| D. | 酚酞的分子式为C20H14O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
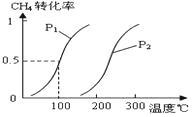 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 L 0.2mol/L的Na2SO4溶液 | B. | 8 L0.15mol/L的Na3PO4溶液 | ||
| C. | 10 L0.1 mol/L的Na2CO3溶液 | D. | 2 L 0.5mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①②④ | B. | ④③②① | C. | ①④②③ | D. | ②①④③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com