
分析 (1)Cl元素的化合价由+1价降低为-1价,Fe元素的化合价由+3价升高为+6价,结合电子、电荷守恒及原子守恒配平;
(2)Mn元素的化合价由+7价降低为+2价,H2O2中氧元素的化合价-1价升高为0,结合电子、电荷守恒及原子守恒配平.
解答 解:(1)Cl元素的化合价由+1价降低为-1价,Fe元素的化合价由+3价升高为+6价,由电荷守恒可知缺项为OH-,电子、电荷及原子守恒可知反应为3ClO-+2Fe(OH)3+4OH-═3Cl-+2FeO42-+5H2O,故答案为:3;2;4OH-;3;2;5;
(2)Mn元素的化合价由+7价降低为+2价,H2O2中氧元素的化合价-1价升高为0,由电子、电荷守恒及原子守恒可知反应为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故答案为:2;5;6H+;2;5;8.
点评 本题为高频考点,侧重氧化还原反应配平的考查,把握反应中元素的化合价变化,注意利用守恒法分析解答,难度不大.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中可能大量存在Al3+、NH${\;}_{4}^{+}$、Cl-、S2- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO${\;}_{4}^{2-}$、I- | |
| C. | 0.1 mol•L-1NaOH溶液大量存在:K+、Na+、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$ | |
| D. | 无色透明溶液中大量存在:K+、Cu2+、SO${\;}_{4}^{2-}$、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
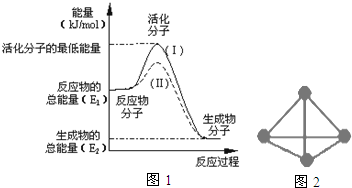
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )| A. | HCl溶液的体积为80mL | B. | a的取值范围为0≤a<50 | ||
| C. | 当a值为30时,b值为0.01 | D. | $\frac{n(Mg)}{n(Al)}$的最大值为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当振荡分液漏斗中的混合溶液时,须用一只手压住分液漏斗的玻璃塞,另一只手握住旋塞,将分液漏斗倒转过来,用力振荡 | |
| B. | 检验氨气的方法是将湿润的蓝色石蕊试纸靠近瓶口或管口,观察试纸是否呈红色 | |
| C. | 向FeCl3溶液中滴加几滴KI溶液,振荡静置后分成两份,向其中一份溶液中加入淀粉,溶液呈蓝色;向另一份溶液中滴加KSCN溶液,溶液呈血红色.该实验说明FeCl3与KI反应有一定的限度 | |
| D. | 铁钉放试管中,加入2mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,不久铁钉周围出现蓝色溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3•H2O+H2O | |
| B. | 在100 mL浓度为1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 硫化钠的水解:S2-+H2O?HS-+OH- | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学是一门“中心的、实用的、创造性的”科学,在能源、资源的合理开发和安全应用方面有重要的作用 | |
| B. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 | |
| C. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 | |
| D. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
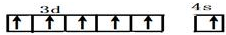 ,B在元素周期表的位置第二周期第ⅣA族
,B在元素周期表的位置第二周期第ⅣA族查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 水解:Al3++3H2O═Al(OH)3 +3H+ | |
| B. | NaHCO3 电离:NaHCO3 ?Na++HCO3- | |
| C. | 固体Ca(OH)2 与NH4Cl共热:NH4++OH-═NH3+H2O | |
| D. | 过量的CO2 气体通入饱和石灰水中:CO2 +OH-═HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com