
| A. | 甲酸能与水以任意比互溶 | |
| B. | 0.1mol/L的甲酸钠溶液的pH约为9 | |
| C. | 0.1mol/L的甲酸溶液的pH约为4.8 | |
| D. | 10mL0.1mol/L的甲酸恰好能与10mL0.1mol/L的NaOH溶液完全反应 |
分析 A.电解质的溶解性大小与强弱电解质无关;
B.甲酸钠溶液呈碱性,证明甲酸钠为强碱弱酸盐;
C.0.1mol/L甲酸溶液的pH约为4.8,说明甲酸部分电离,证明了甲酸为弱电解质;
D.二者恰好反应,只能证明甲酸是一元酸,不能证明甲酸是弱电解质.
解答 解:A.甲酸能与水以任意比互溶,说明甲酸溶解性较大,不能说明甲酸部分电离,则不能证明甲酸是弱电解质,故A错误;
B.0.1mol/L的甲酸钠溶液的pH约为9,证明甲酸钠为强碱弱酸盐,从而证明甲酸为弱酸,故B正确;
C.0.1mol/L甲酸溶液的pH约为4.8,甲酸中氢离子浓度小于0.1mol/L,说明甲酸部分电离,证明了甲酸是弱电解质,故C正确;
D.10mL 0.1mol/L甲酸恰好与10mL 0.1mol/LNaOH溶液完全反应,证明甲酸是一元酸,不能说明甲酸部分电离,则不能证明甲酸是弱电解质,故D错误;
故选BC.
点评 本题考查弱电解质的判断,题目难度不大,明确强弱电解质的本质区别为“在水溶液中能否完全电离”,电解质强弱只根据电离程度大小判断,不能根据其溶解性强弱判断.


科目:高中化学 来源: 题型:选择题
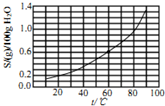
| A. | 25℃时,溴酸银微溶于水 | |
| B. | 溴酸银溶解度随温度升高而增大 | |
| C. | 60℃时溴酸银的Kap约等于2.5×10-4 | |
| D. | 往溴酸银浊液中滴加NaI有黄色固体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeC12+C12=2FeC13 | B. | Fe+CuSO4=Cu+FeSO4 | ||
| C. | C12+2NaOH=NaC1+NaC1O+H2O | D. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 相对分 子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 冬青油 | 152 | 1.180 | 222.2 | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | [CH3COOH]>[H+]>[CH3COO-]>[OH-] | B. | [H+]>[CH3COO-]>[CH3COOH]>[OH-] | ||
| C. | [CH3COOH]>[CH3COO-]>[H+]>[OH-] | D. | [CH3COOH]>[H+]>[OH-]>[CH3COO-] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 3:2 | C. | 2:1 | D. | 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 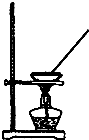 如图所示装置获得碳酸氢钠固体 | B. | 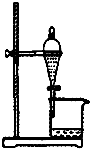 如图所示装置分离乙酸和乙酸乙酯 | ||
| C. | 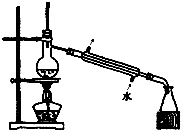 如图所示装置制取少量蒸馏水 | D. |  如图所示装置提纯氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变外界条件使化学平衡状态改变时,平衡常数也一定改变 | |
| B. | 改变条件,反应物的转化率增大,平衡常数一定增大 | |
| C. | 若一个可逆反应的平衡常数很大,则反应会在较短的时间内完成 | |
| D. | 已知2NO2?N2O4正反应的平衡常数为K1,逆反应的平衡常数为K2,则K1=$\frac{1}{{K}_{2}}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com