
【题目】有四位同学分别对四种溶液中所含的离子进行检测,结果如下,其中错误的是
A.Ca2+HCO3-Cl-K+B.OH-CO32-Cl-K+
C.Ba2+Na+OH-NO3-D.Cu2+ NO3-OH-Cl-
【答案】D
【解析】
试题A、B和C三组里的四种离子都不反应能共存,D组里的铜离子和氢氧根离子反应生成氢氧化铜沉淀,选D。
【名师】
判断离子共存时需要考虑
(1)有气体产生。如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、![]() 等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。如3AlO2-+Al3++6H2O=4Al(OH)3↓等。


科目:高中化学 来源: 题型:
【题目】(1)12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为________,X的相对原子质量为________。
(2)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mLA受热完全分解生成15mL O2和10mL F2,则A的化学式为________。
(3)有X、Y、Z三种元素, X原子核内无中子, Y原子的第三个电子层上有2个电子, Z原子最外层电子数是其电子层数的3倍。试画出Y原子结构示意图______________。这三种元素所组成的化合物的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 自发反应的熵一定增大,非自发反应的熵一定减小
B. 吸热的熵增加反应一定能自发进行
C. 反应2Mg(s)+CO2(g)===C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
D. 常温下,反应C(s)+CO2(g)![]() 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.6g H2O的物质的量是______,含有______个水分子,含有______mol H;12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为______,R的相对原子质量为______。含R的质量为1.6g的Na2R,其物质的量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)48g氧气和48g臭氧(O3),它们所含的原子数_______ (填“相同”或“不同”,它们在同温同压下的体积比是________。0.2 mol NH3分子与________个CH4含有的电子数相同,与_______g H2O含有的氢原子数相同,与标准状况下____ L CO含有的原子数相等。
(2)483g Na2SO4·10H2O中所含的Na2SO4·10H2O的物质的量是_______; Na2SO4·10H2O的摩尔质量是________,所含Na+的物质的量是________。含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是________。
(3)实验室常用的浓盐酸密度为1.17 g·mL-1,质量分数为36.5 %。
①此浓盐酸的物质的量浓度为__________________。
②取此浓盐酸50mL,用蒸馏水稀释为200mL,稀释后盐酸的物质的量浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
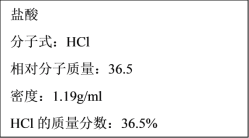
(1)该浓盐酸的物质的量浓度为___mol·L-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500ml物质的量浓度为0.4mol·L-1的稀盐酸,该学生需用量筒量取___ml上述浓盐酸进行配制。
(3)实验室用盐酸的浓溶液与高锰酸钾发生反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O,该反应中的氧化剂是___,还原剂是___。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能正确表达反应颜色变化的原因的是
A. 铜久置空气中表面出现绿色固体:2Cu+O2+CO2+H2O═Cu2(OH)2CO3
B. 某种火箭发射阶段有少量N2O4,逸出,产生红色气体:N2O4![]() 2NO2
2NO2
C. FeSO4·7H2O在空气中久置变黄:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
D. SO2通入KMnO4溶液中,溶液紫色逐渐褪去:5SO2+2KMnO4+2H2O═K2SO4+2MnSO4十2H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组用莫尔盐[化学式为(NH4)xFe(SO4)2·6H2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100mL溶液。
②量取10.00mLKMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积20.00mL,所发生反应的离子方程式如下:4H++5Fe2++MnO4-=5Fe3++Mn2++4H2O请回答下列问题:
(1)(NH4)xFe(SO4)2·6H2O中x=___,c(Fe2+)=___。
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外还有___;
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移、定容操作。下列图对应的操作规范的是___。
a.称量 b.溶解
b.溶解 c.转移
c.转移 d.定容
d.定容![]()
(3)计算KMnO4溶液的物质的量浓度,写出计算过程。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
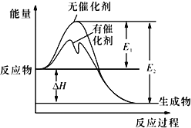
A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C. 该反应中,反应物的总键能小于生成物的总键能
D. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com