
分析 根据配制一定物质的量浓度的溶液中使用的仪器进行判断;根据溶液中硫酸铜的物质的量计算出胆矾的物质的量及质量;胆矾失去部分结晶水,称量的硫酸铜的物质的量偏大,溶液浓度偏高.
解答 解:某实验需要使用240mL0.4mol/LCuSO4溶液,实际上配制的是250mL 0.4mol/L的硫酸铜溶液,该实验操作的步骤为:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,需要使用的仪器有:托盘天平、药匙、烧杯、玻璃棒、250ml 容量瓶、胶头滴管,属于还缺少的仪器为:250mL 容量瓶、胶头滴管;250mL溶液中含有硫酸铜的物质的量为0.1mol,需要淀粉的质量为:250g/mol×0.1mol=25.0g;若所称胆矾失去部分结晶水,导致称量的硫酸铜的物质的量偏大,则配制出的溶液浓度偏高,
故答案为:250mL 容量瓶;胶头滴管;25.0;偏高.
点评 本题考查了配制一定物质的量浓度的溶液的方法,题目难度中等,试题基础性强,难易适中,注重灵活性,掌握实验的步骤是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭 | |
| B. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| C. | 皮肤上溅有较多的浓硫酸,赶紧用水冲洗 | |
| D. | 实验室金属钠着火,立即用水浇灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | NH3$→_{催化剂,△}^{O_{2}}$N2$\stackrel{O_{2},H_{2}O}{→}$HNO3 | |
| C. | SiO2$\stackrel{C/高温}{→}$Si$\stackrel{Cl_{2}、高温}{→}$SiCl4$\stackrel{H_{2}、高温}{→}$Si | |
| D. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2 $\stackrel{电解}{→}$Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
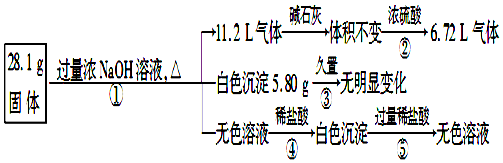
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
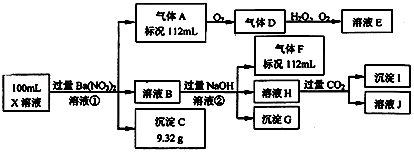
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
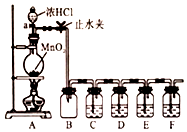 某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:
某化学学习小组为探究Cl2、Br2、I2、Fe3+的氧化性强弱,设计了如图实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
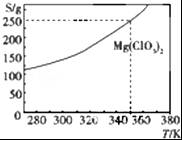 Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )
Mg(ClO3)2可采用复分解反应制备:MgCl2+2NaClO3═Mg(ClO3)2+2NaCl.已知Mg(ClO3)2的溶解度(S)随温度(T)的变化曲线如图所示.下列有关叙述中不正确的是( )| A. | 温度越高,Mg(ClO3)2饱和溶液的物质的量浓度越大 | |
| B. | 温度越高,Mg(ClO3)2饱和溶液的质量分数越大 | |
| C. | 350 K时,Mg(ClO3)2饱和溶液的质量分数为$\frac{250g}{350g}$×100% | |
| D. | 350K时,Mg(ClO3)2饱和溶液的物质的量浓度为$\frac{250g}{191g/mol×1L}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
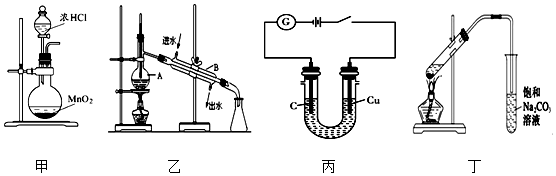
| A. | 利用装置甲制取氯气 | |
| B. | 利用装置乙分离乙酸(沸点:118℃)与乙酸乙酯(沸点:77.1℃) | |
| C. | 利用装置丙可电解食盐水制氯气和氢气 | |
| D. | 利用装置丁制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
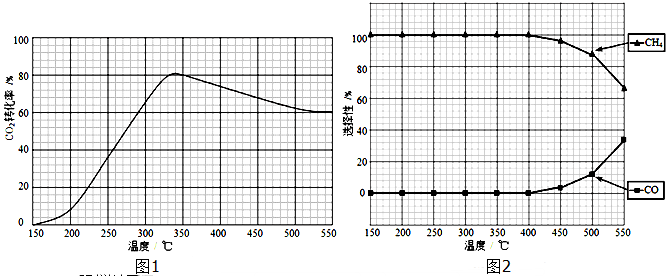
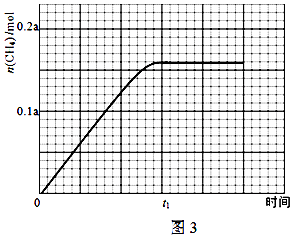
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com