
| A | B | C | D | 单质E | |
| 熔点(℃) | 801 | 710 | 193 | -68 | 2300 |
| 沸点(℃) | 1456 | 1414 | 183 | 57 | 2500 |
| A. | D固体是共价化合物形成的晶体 | |
| B. | B中的键的强度比A中的键的强度大 | |
| C. | 单质E可能是原子之间由共价键直接形成的晶体 | |
| D. | C固体受热能升华 |
分析 A.D熔沸点较低,为分子晶体;
B.A、B可能为离子晶体,键的强度越大,熔沸点越高;
C.单质E的熔沸点较高,可能为原子晶体;
D.C固体的沸点比熔点低.
解答 解:A.D熔沸点较低,为分子晶体,可为共价化合物形成的晶体,故A正确;
B.A、B可能为离子晶体,键的强度越大,熔沸点越高,B的熔点较低,则B中的键的强度比A中的键的强度小,故B错误;
C.单质E的熔沸点较高,可能为原子晶体,则可能是原子之间由共价键直接形成的晶体,故C正确;
D.C固体的沸点比熔点低,则可升华,故D正确.
故选B.
点评 本题考查晶体的类型以及性质,为高频考点,侧重考查学生的分析能力,有利于培养学生的学科素养,注意把握晶体的类型以及晶体的熔沸点的影响因素,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2的反应速率和SO3的生成速率相等 | |
| B. | SO2的物质的量等于SO3的物质的量 | |
| C. | SO2的物质的量不再变化 | |
| D. | SO2的百分含量是O2百分含量的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
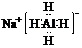 ,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.
,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠离子的电子式:Na+ | B. | 碳-12原子:${\;}_{12}^{6}$C | ||
| C. | 氯化钙电子式: | D. | OH-的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件和部分副产 物未标出),其中反应①是置换反应.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件和部分副产 物未标出),其中反应①是置换反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Br的电子式: | |
| B. | S2-的结构示意图: | |
| C. | 比例模型 可以表示甲烷分子,不可以表示四氯化碳分子 可以表示甲烷分子,不可以表示四氯化碳分子 | |
| D. | 丙烷的结构简式:CH3CH2CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com