
某工厂废水中含游离态氯,通过下列实验测定其浓度。①取水样10.0ml于锥形瓶中,加入10.0ml的K I溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。②取一滴定管依次用自来水、蒸馏水洗净后,马上注入0.01mol·L-1Na2S2O3溶液,调整液面,记下读数。③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+ 2Na2S4O6 试回答下列问答:
⑴步骤①加入的指示剂是 。
⑵步骤②应使用 式滴定管。
⑶判断达到滴定终点的实验现象是 ;
⑷氯的实际浓度比所测浓度会偏小,造成误差的原因是
(5)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是
A、酸式滴定管未用标准盐酸溶液润洗 B、锥形瓶未用待测液润洗
C、滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D、滴定时将标准液溅出锥形瓶外
科目:高中化学 来源: 题型:
 而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由右图判断下列
而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由右图判断下列
关系错误的是
A.A→F,△H = - △H 6
B.△H1+△H 2+△H 3+△H 4+△H 5+△H 6=1
C.C→F,|△H| = |△H 1+△H 2+△H 6 |
D.△H 1+△H 2+△H 3 = -△H 4-△H5-△H 6
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.有以下几种物质:①食盐晶体 ②乙醇 ③水银 ④蔗糖 ⑤冰醋酸(纯醋酸晶体)
⑥KNO3溶液 ⑦熔融的氢氧化钠 ⑧液态氯化氢 填空回答(填序号):
(1)物质中构成的微粒只能在固定位置上振动的是 ;(2)以上物质可以导电是 ;
(3)以上物质中属于电解质的是 ; (4)以上物质中属于非电解质是 。
Ⅱ. (1) O2、SO2、SO3三者质量之比为1∶2∶5,则它们的氧原子数之比为 。
(2)某金属氯化物MCl2 40.5 g中含有0.6 mol Cl-,则MCl2的摩尔质量为 ,金属M的相对原子质量为 。
(3)在V LFe2(SO4)3溶液中含有m g Fe3+,则C Fe3+为_______________;从中取出V/4L溶液,则SO42-物质的量浓度为_______________;再将这V/4L溶液溶液稀释到4L,稀释后溶液中溶质的物质的量浓度为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是 ( )
A. NH4NO3 溶于水吸热,但仍能自发进行,是因为该过程熵增加
B. 同一种物质气态时熵值最大,液态时次之,而固态时熵值最小
C. 不借助于外力而自发进行的过程,其体系的能量一定是由高能状态转变为低能状态
D.要判断反应进行的方向,必须综合考虑体系的焓变和熵变.
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中发生如下反应:aX(g)+bY(g) cZ(g)+dW(g),反应达平衡后,W的浓度为0.5mol•L-1,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为0.8mol•L-1。下列叙述不正确的是 ( )
A.平衡向逆反应方向移动 B.a+b > c+d
C.Z的体积分数减少 D.X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO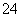 的物质的量浓度为6 mol·L-1,则此溶液最多能溶解的铁粉的质量为( )
的物质的量浓度为6 mol·L-1,则此溶液最多能溶解的铁粉的质量为( )
A.5.6 g B.11.2 g C.22.4 g D.33.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是
A.lmol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L0.5 mol • L-1硫酸钾溶液中阴离子所带电 荷数为NA
荷数为NA
C.1 mo l Na2O2固体中含离子总数为4NA
l Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体 中氢原子的个数为6 NA
中氢原子的个数为6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
铜和镁的合金4.6 g完全溶于浓硝酸,若反应后硝酸被还原只产生4 480 mL的NO2气体和336 mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )
A.9.02 g B.8.51 g
C.8.26 g D.7.04g
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)火法炼锌是将闪锌矿(主要成分是ZnS)通过浮选焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热到1 100~1 300 ℃,使锌蒸馏出来。
①写出火法炼锌的主要反应:
焙烧反应:_________________________________________。
鼓风炉中可能发生的反应:___________________(任写一个)
②从保护环境和充分利用原料角度看如何处理和利用产生的烟气?_____________________________________________________________________________。
(2)工业上冶炼铝就是电解氧化铝
①冶炼铝的电解槽中的阴极和阳极材料均用石油炼制和煤的干馏产品________(填物质名称)。
②氧化铝的熔点很高,在铝的冶炼中要加入冰晶石(Na3AlF6),其作用是________________________________________________。
③工业上冶炼铝时用的原料是Al2O3,而不是AlCl3,其原因是
______________________________________________________。
(3)工业上“联合制碱法”中主要反应的化学方程式是_______________________________________。
其中的CO2来源于______________。
(4)碳酸钙是制玻璃的原料之一,工业上制玻璃是在玻璃熔炉中进行,其中反应之一为CaCO3+SiO2CaSiO3+CO2↑,若在上述条件下,把1 000a g CaCO3和60a g SiO2混合,则生成的CO2在标准状况下的体积为________________(用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com