
 CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g).
CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g).分析 (1)H2O将CH4氧化为CO,反应中C元素化合价由-4价升高为+2价,化合价总共升高6价,该反应中转移6e-,结合n=$\frac{m}{M}$解答;
(2)根据已知方程式构建目标方程式④,根据盖斯定律计算反应热;
(3)①根据v=$\frac{△c}{△t}$计算v(CH4),再根据速率之比等于化学计量数之比计算v(H2);
②化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值;
③当温度升高到(T+100)℃时,容器中c(CO)=0.75mol•L-1,CO浓度增多,所以平衡向正反应方向移动,升高温度平衡向吸热的方向移动,据此分析解答;
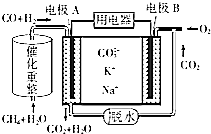
(4)CH4+2H2O?CO+3H2,原电池工作时,CO和H2失电子在负极反应,则A为负极,CO和H2被氧化生成二氧化碳和水,正极B上为氧气得电子生成CO32-,以此解答该题.
解答 解:(1)8gCH4的物质的量为n=$\frac{m}{M}$=$\frac{8g}{16g/mol}$=0.5mol,CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g)?CO(g)+3H2(g),反应中C元素化合价由-4价升高为+2价,化合价总共升高6价,该反应中转移6e-,则0.5molCH4反应转移3mol电子,
故答案为:3;
(2)①2CO(g)+O2(g)?2CO2(g)△H1=akJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H2=bkJ•mol-1
③CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H3=ckJ•mol-1
根据盖斯定律可知:③+②×3-①×2,得到④CH4(g)+2H2O(g)?CO(g)+3H2(g)所以△H4=(c+3b-2a)kJ•mol-1,
故答案为:c+3b-2a;
(3)①向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O?CO(g)+3H2(g),反应开始c(CH4)=1mol•L-1,经过tmin,反应达到平衡.已知平衡时,c(CH4)=0.5mol•L-1,v(CH4)=$\frac{0.5mol/L}{tmin}$=$\frac{0.5}{t}$mol/(L•min),速率之比等于化学计量数之比,则v(H2)=3v(CH4)=3×$\frac{0.5}{t}$mol/(L•min)=$\frac{1.5}{t}$mol/(L•min),
故答案为:$\frac{1.5}{t}$mol/(L•min);
②T℃时,1L恒容密闭容器中CH4(g)+H2O?CO(g)+3H2(g)
起始量(mol):1 1 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 0.5 0.5 1.5
平衡常数K=$\frac{C(CO)×C({H}_{2})}{C(C{H}_{4})×C({H}_{2}O)}$=$\frac{(\frac{1.5}{t})^{3}×(\frac{0.5}{t})}{\frac{0.5}{t}×\frac{0.5}{t}}$=$\frac{6.75}{{t}^{2}}$=6.75,
故答案为:6.75;
③升高温度平衡向吸热的方向移动,T℃时,容器中c(CO)=0.5mol•L-1,当温度升高到(T+100)℃时,容器中c(CO)=0.75mol•L-1,CO浓度增多,平衡向正反应方向移动,所以正反应为吸热反应,
故答案为:吸热;
(4)①原电池工作时,CO和H2失电子在负极反应,则A为负极,CO和H2被氧化生成二氧化碳和水,电池工作时,阳离子向正极移动,B为正极,即K+和Na+向电极B移动,
故答案为:B;
②甲烷和水蒸气反应CH4+2H2O?CO+3H2,原电池工作时,A为负极,负极上CO和H2失电子发生了氧化反应,CO和H2被氧化生成二氧化碳和水,电极反应为:3H2+CO+4CO32--8e-=3H2O+5CO2,B为正极,正极为氧气得电子生成CO32-,反应为2O2+4CO2+8e-=4CO32-,
故答案为:3H2+CO+4CO32--8e-=3H2O+5CO2.
点评 本题考查了反应热的计算、化学平衡的影响因素、化学电源新型电池,掌握盖斯定律的应用、化学平衡移动的影响因素、明确原电池中物质得失电子、电子流向、离子流向即可解答,难点是电极反应式书写,要根据电解质确定正负极产物,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol•L-1 | B. | 0.30 mol•L-1 | C. | 0.15 mol•L-1 | D. | 0.5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ | |
| B. | 因CuSO4•5H2O(s)=CuSO4(s)+5H2O(1)△H=+b kJ/mol,故1 mol CuSO4( s)溶于足量水时,放出热量为b kJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(1)=2H2( g)+O2( g)△H=+c kJ/mol | |
| D. | 因N2( g)+3H2( g)?2NH3( g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2 充分反应后,放出热量小于d kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 物质 X在空气中不易被氧化 | |
| B. | 物质 Y中只含一个手性碳原子 | |
| C. | 物质 Z中所有碳原子不可能在同一平面内 | |
| D. | 等物质的量的 X、Y分别与 NaOH反应,最多消耗 NaOH的物质的量之比为 1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠着火后,可用泡沫灭火器来灭火 | |
| B. | 氧化钠和过氧化钠都属于碱性氧化物 | |
| C. | 过氧化钠与水的反应中,Na2O2作氧化剂,水作还原剂 | |
| D. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com