
以甲醇为替代燃料是解决我国石油资源短缺的重要措施。
(1)CO、CO2可用于甲醇的合成,其相关反应的热化学方程式如下:
CO(g)+2H2(g)=CH3OH(g) △H=" -102.5" kJ·mol-1
CO(g)+H2O(g) = CO2(g)+H2(g) △H ="-42.9" kJ·mol-1
则反应CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H = kJ·mol-1
反应CO(g)+H2O(g) = CO2(g)+H2(g)的平衡常数K的表达式为 。
(2)用CO2合成甲醇时可选用亚铬酸锌(ZnCr2O4)或CuCl为催化剂。
①工业制备亚铬酸锌是用CO还原ZnCrO4·H2O,同时生成ZnO。该反应的化学方程式是 。以亚铬酸锌为催化剂时,工业上的适宜温度是:350℃~420℃,可能的原因是 。
② CuCl是不溶于水的白色固体,制备时向CuCl2溶液中加入过量铜粉,发生反应CuCl2+Cu=2CuC1。在实验过程中应先加入浓盐酸,发生反应CuCl + HCl H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7。
H[CuCl2]。反应结束后将溶液倒入蒸馏水中有CuCl生成。实验过程中加入浓盐酸的目的是 。当c(Cl-)=2×10-3 mol·L—1时, c(Cu+-)= mol·L—1。已知:Ksp(CuCl)=1.7×10-7。
(3)直接甲醇燃料电池结构如图所示,则负极反应是 。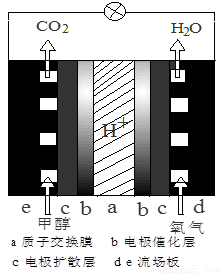
(14分)每空2分
(1)- 59.6 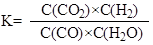
(2)①2ZnCrO4·H2O+3CO="ZnO+" ZnCr2O4+3CO2+2H2O
此时催化剂亚铬酸锌的活性最大(或温度升高,反应速率增大)
②促使平衡正向移动,防止CuCl固体覆盖在Cu表面,影响反应的进行 8.5×10-5
(3)CH3OH+H2O-6e-=CO2+6H+
【解析】
试题分析:(1)通过热化学方程式的叠加,CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H= - 59.6。
化学平衡常数等于生成物浓度的幂之积除以反应物难度的幂之积,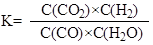 。
。
(2)①根据题中的反应物、生成物,反应的方程式为2ZnCrO4·H2O+3CO="ZnO+" ZnCr2O4+3CO2+2H2O。
温度对化学反应的速率影响较大且催化剂需要适当的温度活性才大,故工业上的适宜温度是:350℃~420℃,可能的原因是此时催化剂亚铬酸锌的活性最大(或温度升高,反应速率增大)。
②应为加入浓盐酸会发生CuCl + HCl H[CuCl2],故实验过程中加入浓盐酸的目的是,促使平衡正向移动,防止CuCl固体覆盖在Cu表面,影响反应的进行。
H[CuCl2],故实验过程中加入浓盐酸的目的是,促使平衡正向移动,防止CuCl固体覆盖在Cu表面,影响反应的进行。
Ksp(CuCl)= c(Cl-) ×c(Cu+-)=1.7×10-7,c(Cl-)=2×10-3 mol·L—1,故c(Cu+-)8.5×10-5 mol·L—1。
(3)甲醇燃料电池中,甲醇是负极,失去电子,化合价所给,电极式为CH3OH+H2O-6e-=CO2+6H+。
考点:反应热的计算 平衡常数的计算 化学方程式的书写 燃料电池 溶度积 电极式的书写
点评:本题考查反应热的计算、平衡常数的计算、化学方程式的书写、燃料电池、溶度积、电极式的书写等知识,题目难度较大,注意题中信息的利用。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 试运用所学知识,解决下列问题:
试运用所学知识,解决下列问题: H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省焦作市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
有效利用现有资源是解决能源问题的一种实际途径。发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:

(1)该过程中产生的的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K=_____________。
(2)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)燃烧热的热化学方程式_____________。
(3)“催化还原”反应制乙二醇原理如下: CH3OOC—COOCH3(g)+4H2(g) HOCH2-CH2OH(g)+2CH3OH(g)? △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g)? △H=-34kJ/mol
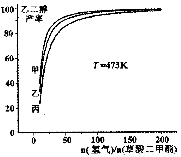
为探究实际生产的最佳条件,某科研小组进行了多方面研究。如图表示乙二醇达到平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线丙对应的压强是P(丙)=_____________。
(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸①草酸氢钾溶液中存? 在如下平衡: H2O H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-和____________。
H++C2O42-和____________。
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液中各粒子浓度关系正确的是__________(填序号)。
A.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
B.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
C.c(Na+)=c(H2C2O4)+c(C2O42-)
D.c(K+)>c(Na+)
(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为_____________;若以甲烷代替该燃料电池中的甲醇,向外界提供相等电量,则每代替3.2g甲醇,所需标准状况下的甲烷的体积为____________L。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |

查看答案和解析>>
科目:高中化学 来源:2011年福建省福州一中高考化学模拟试卷(解析版) 题型:解答题
 H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 时间/s | 20 | 40 | 60 | 80 | |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com