
【题目】决定化学反应速率的主要因素是
A.反应物的浓度B.是否使用合适的催化剂
C.外界温度的高低D.反应物的本身性质
科目:高中化学 来源: 题型:
【题目】根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算铜元素相对原子质量。提供的实验仪器及试剂如下(根据需要可重复选用,加入的氯化铵与氢氧化钙的量足以产生使氧化铜完全还原的氨气):
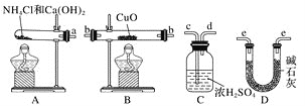
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________。
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________。
(3)在本实验中,若测得m(CuO)=ag,m(H2O)=bg,则Ar(Cu)=_____________________。
(4)在本实验中,使测定结果Ar(Cu)偏大的是________________(填序号)。
①氧化铜未完全起反应 ②氧化铜不干燥 ③氧化铜中混有不反应的杂质 ④ 碱石灰不干燥 ⑤氯化铵与氢氧化钙混合物不干燥
(5)在本实验中,还可通过测定________和________,或________和________达到实验目的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. AlCl3溶液中滴加过量NH3·H2O:Al3+ + 4OH-= AlO2-+ 2H2O
B. 钠与水的反应:Na+2 H2O =Na++2OH-+H2↑
C. NaHSO4溶液中加BaCl2溶液:SO42-+Ba2+=BaSO4↓
D. 氯气与水的反应:Cl2 + H2O = 2 H+ + ClO-+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酸、碱、盐的说法中正确的是( )
A.酸根中不可能含有氧元素B.能与碱发生反应生成水的化合物是酸
C.电离时有金属阳离子产生的化合物一定是盐D.酸不可能电离产生金属阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(3)电化学法是合成氨的一种新方法,其原理如图所示,阴极的电极反应式是_____。

(4)废水中含氮化合物的处理方法有多种。
① NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液______________L。
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是______________kJ。
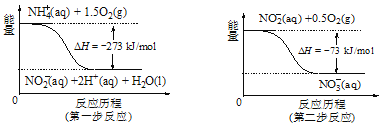
③ 用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH______(填“升高”、“降低”或“不变”)。
(5)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。若某次捕捉后得到pH=10 的溶液,则溶液c(CO32-)∶c(HCO3-)=_______。 [常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是
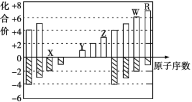
A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一种天然产物,具有一定的除草功效。下列有关该化合物的说法错误的是

A. 分子中含有三种含氧官能团
B. 1mol该化合物最多能与4molNaOH反应
C. 既可以发生取代反应,又能够发生加成反应
D. 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )
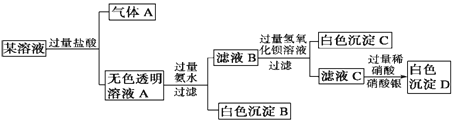
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Atropic 酸(H)是某些具有消炎、镇痛作用药物的中间体,其一种合成路线如下:
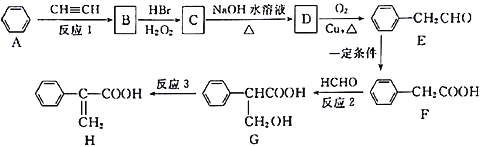
(1)G中含氧官能团的名称是____________;反应1为加成反应,则B的结构简式是________________。
(2)反应2的反应类型为________________,反应3的反应条件为________________。
(3)C→D的化学方程式是________________________________。
(4)写出E与银氨溶液水浴反应的离子方程式_______________________________。
(5)下列说法正确的是________。
a. B中所有原子可能在同一平面上
b. 合成路线中所涉及的有机物均为芳香族化合物
c.一定条件下1mol有机物H最多能与5molH2发生反应
d. G能发生取代、加成、消去、氧化、缩聚等反应
(6)化合物G有多种同分异构体,其中同时满足下列条件:①能发生水解反应和银镜反应; ②能与FeC13发生显色反应;③核磁共振氢谱只有4个吸收峰的同分异构体的结构简式是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com