
【题目】下图表示有机物M转化为X、Y、Z、W的四个不同反应。下列叙述正确的是
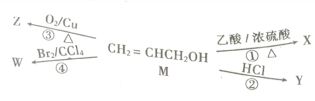
A. 与X官能团相同的X的同分异构体有9种
B. 反应②一定属于加成反应
C. W分子中含有两种官能团
D. Z的分子式为C3H2O
【答案】C
【解析】乙酸和丙烯醇发生酯化反应生成乙酸丙烯酯(X),与官能团相同的X的同分异构体有:HCOO-CH2-CH2-CH=CH2,这样有机物有8种,CH3-COO-CH=CH-CH3,这样有机物有3种(包括本身),CH3-CH2COO-CH=CH2 (1种),CH2=CHCOO- CH2CH3(1种),CH2=CH-CH-COOCH3,这样有机物有3种,所以,与X官能团相同的X的同分异构体还有15种,A错误;氯化氢与碳碳双键发生加成反应,也可以和醇羟基发生取代反应,B错误;溴与碳碳双键发生加成反应,生成溴代醇,官能团为溴原子和羟基,C正确;醇发生催化氧化变为丙烯醛,分子式为C3H4O,D错误;正确选项C。


科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是
A. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8 kJ/mol
B. 已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C. 已知2C(s)+2O2(g)=2CO2(g) △H1; 2C(s)+O2(g)=2CO(g) △H2;,则△H1>△H2
D. 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热方程式为NaOH(aq)+ HCl(aq)=NaCl(aq)+H2O(l) △H=一57.4kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上新建的金矿中约有80%都采用氧化法提金。某工厂利用锌冶炼渣回收金、银等贵金属的流程如下图所示:

已知:HCN有剧毒,其Ka(HCN)=5×10-10,
Au++2CN-=[Au(CN)2]-平衡常数KB=1×1038
(1)磨矿细度对浸出率的影响如图所示,依据浸出率应选择磨矿细度_____为宜。

(2)生产中用生石灰调节矿泥pH>11.5,其目的之一是阻止溶液中的氰化物转化为HCN而挥发,其作用原理是________________(用离子方程式表示)。
(3)“氰化”环节,是以NaCN溶液浸取调节pH的矿泥,敞口放置,将Au转换为Na[Au(CN)2]。
①其化学方程式为________________。
② “氰化”环节中,金的溶解速率在80℃时达到最大值,但生产中控制反应液的温度在10-20℃,原因是:___________________________(答一点即可)。
③已知2H++[Au(CN)2]-![]() Au++2HCN,该反应的K=____________。
Au++2HCN,该反应的K=____________。
(4)用锌还原NaAu(CN)2生成金,消耗的锌与生成的金的物质的量之比为____________。
(5)氰化物有剧毒,经合理处理就可以基本消除对环境的负面影响。H2O2可消除水中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O=A+NH3↑。
①生成物A的化学式为______________。
②某废水用H2O2处理40min后,测得剩余总氰为0.16mg/L,除氰率达80%,计算0-40min时间段反应速率v(CN-)=____mg/(L·min)(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应X2(g)+Y2(g)2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,图中对此过程的分析正确的是

A. 图I是加入适当催化剂的变化情况
B. 图Ⅱ是扩大容器体积的变化情况
C. 图Ⅲ是增大压强的变化情况
D. 图Ⅲ是升高温度的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质是生命的物质基础。某学习小组通过实验探究一种蛋白质的元素组成。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是_________________。
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如下图装置进行研究,通入氧气使样品在装置A中充分燃烧,并使其产物依次缓缓通过其余装置。

①装置B中的试剂是_________。
②装置D的作用是____________________。
③当装置B、C、E、F依次出现下列现象:________________,品红褪色,______________,出现白色浑浊;可证明燃烧产物中含有H2O、SO2、CO2。
结论:该蛋白质中含碳、氢、硫、氮等元素。
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫,再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2S2032-+I2=S4062-+2I-
(3)写出二氧化硫与碘水反应的化学方程式:___________________________。
(4)滴定终点的现象为:______________________。
(5)取蛋白质样品mg进行测定,采用C1mol/L的碘水V1mL进行吸收,滴定过量的碘时消耗C2mol/L硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为______________。
(6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值___(填“偏大”或“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的说法中正确的是( )
A. 苯与H2在一定条件下的加成产物环己烷![]() 中,所有碳原子在同一平面上
中,所有碳原子在同一平面上
B. ![]() 可以用于表示苯的分子结构,但是其中并不含有碳碳双键,因此苯的性质跟烯烃不相同
可以用于表示苯的分子结构,但是其中并不含有碳碳双键,因此苯的性质跟烯烃不相同
C. 苯的分子式是C6H6,苯分子中的碳原子远没有饱和,因此能与溴水发生加成反应而使之褪色
D. 苯环上的碳碳键是一种介于单键和双键之间的独特的键,因此苯可以发生取代反应不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)100°C时,KW=1.0×10﹣12,在该温度下,测得0.1mol/LNa2A溶液pH=6.
①H2A在水溶液中的电离方程式为_____;
②体积相等pH=1的盐酸与H2A溶液分别与足量的Zn反应,与盐酸相比,H2A溶液产生的H2____(填“多”、“少”或“一样多”).
(2)将0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液中c(Na+)>c(B-)。
①混合溶液中c(B﹣)_____c(HB)(填“>”、“<” 或“=”);
②混合溶液中c(HB)+ c(B-)_____0.2mol/L(填“>”、“<”或“=”).
(3)已知在常温下常见弱酸的电离平衡常数Ka如表所示:
溶质 | CH3COOH | H2CO3 | HClO | HCN |
电离平衡常数Ka | 1.75×10-5 | Ka1=4.4×10-7 Ka2=4.7×10-11 | 3.2×10-8 | 6.2×10-10 |
①少量二氧化碳通入NaClO溶液中的离子方程式_____;
②浓度均为0.01mol/L的下列4种物质的溶液分别加水稀释100倍,pH变化最小的是_____(填编号);
a.CH3COOH b.HCN c.HClO d.H2CO3
③常温下浓度相同的醋酸和醋酸钠混合液pH=6,则c( CH3COO-)﹣c( CH3COOH)=___mol/L(用数值列出计算式即可).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
【答案】 NaHSO4=Na++H++SO42- 酸 Al2O3 Fe2++2H2OFe(OH)2+2H+ 抑制Fe2+水解 防止Fe2+氧化 1.0×10-12 11
【解析】(1). NaHSO4是强酸的酸式盐,在水溶液中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2).AlCl3是强酸弱碱盐,水解使溶液呈酸性;Al3++3H2O![]() Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3
Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3 ![]() Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
(3).实验室配制FeSO4溶液,因亚铁离子发生水解:Fe2++2H2O![]() Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O
Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O![]() Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
(4).① . t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,则Kw= c(H+)×c(OH-)= 10-a mol·L-1×10-b mol·L-1=1.0×10-(a+b),已知a+b=12,则Kw=1.0×10-12,故答案为:1.0×10-12;
②在该温度下,100mL 0.1 mol·L-1的稀H2SO4溶液中n(H+)=0.1L×0.1 mol·L-1×2=0.02mol,100mL 0.4 mol·L-1的NaOH溶液中n(OH-)=0.1L×0.4 mol·L-1=0.04mol,两溶液混合后氢氧根离子过量,所得溶液中c(OH-)=![]() = 0.1mol/L,则c(H+)=
= 0.1mol/L,则c(H+)=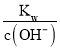 =10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
=10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
【题型】综合题
【结束】
24
【题目】已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
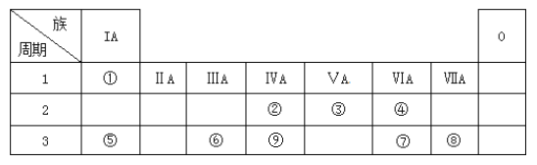
(1)第三周期中元素非金属性最强的元素的原子结构示意图为__________。
(2)②③⑨最高价氧化物对应水化物酸性强弱顺序为(填化学式)_____________。
(3)用电子式表示④的氢化物的形成过程_________________________。
(4)下列可以判断⑤和⑥金属性强弱的是__________。
a. ⑤单质的熔点比⑥单质低
b. ⑤的化合价比⑥低
c. ⑤单质与水反应比单质⑥剧烈
d. ⑤最高价氧化物的水化物的碱性比⑥强
(5)由表中①、③、④、⑥、⑧元素形成的常见物质Z、M、N可发生以下反应:
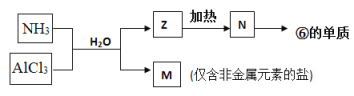
a. M中所含的化学键种类为(若含共价键,请标明极性或非极性)_________。
b. N→⑥的单质的化学方程式_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com