
| A. | NO3- | B. | -Cl | C. | -OH | D. | 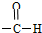 |
科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(NH4+)=2c(OH-) | |
| B. | 由H2O电离出的c(H+)=1.0×10-12mol•L-1 | |
| C. | 与等体积等浓度的氯化铵溶液混合c(NH4+)+c(NH3•H2O)=0.02 mol•L-1 | |
| D. | 与等体积等浓度的盐酸混合后所得溶液c(OH-)+c(NH3•H2O)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅是将太阳能转化为电能的常用材料 | |
| B. | CaO能与SO2反应,可作工业废气的脱硫剂 | |
| C. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
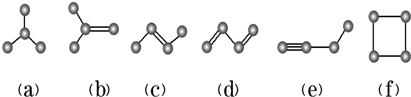
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | |
| 浓度1 | 0.05mol•L-1 | a mol•L-1 | 0.05mol•L-1 |
| 浓度2 | 0.078mol•L-1 | 0.078mol•L-1 | 0.022mol•L-1 |
| 浓度3 | 0.06mol•L-1 | 0.06mol•L-1 | 0.04mol•L-1 |
| 浓度4 | 0.07mol•L-1 | 0.07mol•L-1 | 0.098mol•L-1 |
| A. | 由[浓度3]与[浓度1]的比较,可判断平衡移动的原因是增大了体系的压强 | |
| B. | 由[浓度2]与[浓度1]的比较,可判断正反应是放热反应 | |
| C. | [浓度1]中a=0.05 | |
| D. | 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4].与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
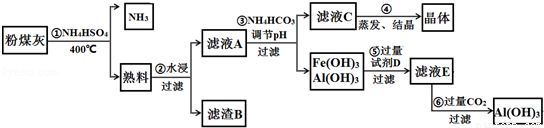
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
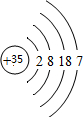 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
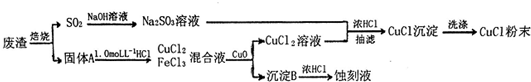
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com