
| A. | 自然界中不存在游离态的硫 | |
| B. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| C. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 | |
| D. | 浓硫酸可用来干燥H2S、CO、Cl2等气体 |
分析 A.火山口存在游离态的硫;
B.发生复分解反应生成亚硫酸钠;
C.二氧化硫中硫元素化合价处于中间价态可以升高也可以降低;
D.浓硫酸具有吸水性,且与SO2、CO、Cl2等不反应.
解答 解:A.自然界中存在游离态的硫,如火山口存在游离态的硫,故A错误;
B.二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了酸性氧化物的性质,与漂白性无关,故B错误;
C.二氧化硫的生成可以是浓硫酸被还原生成,也可以是硫单质燃烧被氧化生成,故C正确;
D.浓硫酸具有吸水性,可干燥CO、Cl2等气体,H2S具有还原性可以被浓硫酸氧化,故D错误;
故选C.
点评 本题考查含硫物质的性质,侧重二氧化硫、浓硫酸性质的考查,注意性质与现象、用途的关系即可解答,注重基础知识的训练,题目难度不大.


科目:高中化学 来源: 题型:填空题
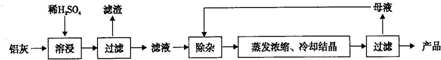
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中存在两种电离平衡 | |
| B. | 不同原子之间形成的共价键不一定是极性共价键 | |
| C. | 向久置于空气中的Na2SiO3、NaOH、CaCl2、漂白粉溶液里加足量盐酸,都能产生气体 | |
| D. | 将少量酸化的FeCl2溶液滴入过氧化氢溶液中,溶液变黄,并产生大量的气泡. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
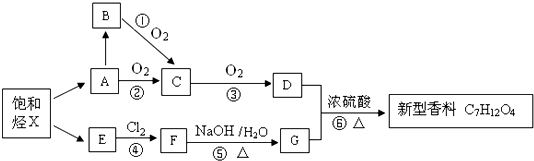
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
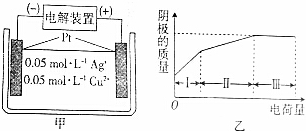
| A. | 区间Ⅰ,在阴极上有金属银析出 | |
| B. | 区间Ⅰ、Ⅱ、Ⅲ中溶液的pH均降低 | |
| C. | 区间Ⅱ,在阳极上有氧气放出 | |
| D. | 区间Ⅱ析出的固体质量是区间Ⅰ的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏目的是将含碳原子数较少的烃先气化经冷凝而分离出来 | |
| B. | 石油经过常、减压分馏、裂化等工序炼制后即能制得纯净物 | |
| C. | 石油的裂化是把相对分子质量较大的烃分子断裂为相对分子质量较小的烃分子 | |
| D. | 工业上通过石油裂解制取大量乙烯、丙烯,乙炔;通过石油催化重整获取芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com