
 (1)人们在对烷烃分子空间结构的研究中发现某一系列的烷烃分子只有一种一卤代物.如:
(1)人们在对烷烃分子空间结构的研究中发现某一系列的烷烃分子只有一种一卤代物.如:| 92.3 |
| 12 |
| 7.7 |
| 1 |
| 179.2L |
| 22.4L/mol |
 ;B是具有两个支链的链状化合物,分子中只有两种不同化学环境的氢原子,为非极性分子,则B为:HC≡C-C(CH3)=C(CH3)-C≡CH;C是饱和烃,分子中碳原子的化学环境完全相同,则为立方烷:
;B是具有两个支链的链状化合物,分子中只有两种不同化学环境的氢原子,为非极性分子,则B为:HC≡C-C(CH3)=C(CH3)-C≡CH;C是饱和烃,分子中碳原子的化学环境完全相同,则为立方烷: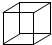 ,故答案为:
,故答案为: ;HC≡C-C(CH3)=C(CH3)-C≡CH;
;HC≡C-C(CH3)=C(CH3)-C≡CH; .
.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
 化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:
化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,例如,金属就是我们生活中不可或缺的重要材料,根据你学过的有关金属的知识,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.| 分子 | H2O | H2S |
| 中心原子杂化方式 | sp3 | |
| 键角 | 104.5° | 92.1° |
| 键长 | 95.7pm | 133.6pm |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在溴水中存在如下平衡:Br2+H2O?HBr+HBrO,当加入NaOH溶液后颜色变浅 |
| B、对2H2O2?2H2O+O2的反应,使用MnO2可加快制O2的反应速率 |
| C、反应CO+NO2?CO2+NO△H<0,升高温度使平衡向逆反应方向移动 |
| D、合成氨反应:N2+3H2?2NH3△H<0,为提高氨的产率,理论上应采取低温高压的措施 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com