
【题目】原子序数依次增加的前四周期的主族元素A~I,有关性质如下:
元素代号 | A | B | C | D | E | F | G | H | I |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.197 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +2 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,回答有关问题:
(1)元素G在周期表中的位置是_______,元素C的气态氢化物的电子式为_______。
(2)元素A、B、G可形成化合物B A4G,该化合物中存在的化学键有_______, E的单质晶体属于_______晶体(填“离子”、“分子”或“原子”),
(3)元素D、G、I的非金属性由强到弱的顺序是________(用元素符号表示),
(4)元素C、D的气态氢化物的稳定性顺序为_______(用化学式表示),元素D的单质可以将元素C从化合物A2C中置换出来,该置换反应的化学方程式为_______。
【答案】 第三周期ⅦA族 ![]() 离子键、共价键 原子 F﹥ Cl﹥ Br HF﹥H2O 2H2O + 2F2 = 4HF + O2
离子键、共价键 原子 F﹥ Cl﹥ Br HF﹥H2O 2H2O + 2F2 = 4HF + O2
【解析】根据表格数据,D、G、I的最低负价均为-1价,其中G、I有+7价,则D为F元素;I的原子半径大于G,则G为Cl元素,I为Br元素。E存在+4和-4价,为第ⅣA族元素,E的单质是一种常见的半导体材料,为Si元素。F的原子序数大于E,小于G,则F为S元素;H的原子序数大于G,化合价为+2价,则H为Ca元素。根据BC的原子序数的关系和原子半径的大小可知,B为N元素,C为O元素,则A为H元素。
根据上述分析可知,A为H元素,B为N元素,C为O元素,D为F元素,E为Si元素,F为S元素,G为Cl元素,H为Ca元素,I为Br元素。
(1)元素G为Cl元素,在周期表中位于第三周期,第ⅦA族,元素C的气态氢化物为水,电子式为![]() ,故答案为:第三周期,第ⅦA族;
,故答案为:第三周期,第ⅦA族;![]() ;
;
(2)元素A、B、G可形成化合物NH4Cl,为铵盐属于离子化合物,该化合物中存在的化学键有离子键、共价键;硅晶体为空间网状结构的晶体,属于原子晶体,故答案为:离子键、共价键;原子;
(3)同一主族,从上到下,非金属性减弱,同一周期,从左向右,非金属性增强。元素D、G、I的非金属性由强到弱的顺序为F﹥ Cl﹥ Br,故答案为:F﹥ Cl﹥ Br;
(4)同一周期,从左向右,非金属性增强,则对应氢化物的稳定性增强。元素C、D的气态氢化物的稳定性顺序为HF﹥H2O,元素D的单质可以将元素C从化合物H2O中置换出来,反应的化学方程式为2H2O + 2F2 = 4HF + O2,故答案为:HF﹥H2O; 2H2O + 2F2 = 4HF + O2。


科目:高中化学 来源: 题型:
【题目】已知: 2NO2(g)+ CH4(g)![]() N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比=
N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比=![]() ] ;下列说法不正确的是
] ;下列说法不正确的是

A. ΔH < 0
B. X > 2
C. 400K时,反应的平衡常数为5×10-2
D. 投料比为2时,Q点v逆(CH4)小于P点的v逆(CH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是一种在生产和生活中应用广泛的金属元素。己知:
反应Ⅰ:Fe2O3(s)+ 3H2(g)=2Fe(s)+3H2O(g) ΔH1= +89 .6kJ /mol
反应Ⅱ:4Fe2O3(s)+Fe(s)=3Fe3O4(s) ΔH2=+2833.4kJ/mol
反应Ⅲ:Fe(s)+2HCl(g)![]() FeCl2(l)+H2(g) ΔH3
FeCl2(l)+H2(g) ΔH3
(1)反应Ⅰ的平衡常数表达式K=______________,该反应在高温下进行,最易生成的副产物是________________ (填化学式)。
(2)温度为T1时,恒容密闭容器中发生反应Ⅲ,反应时间与体系压强关系如图a所示,体系温度与HCl转化率关系如图b所示。
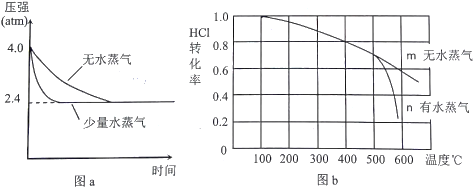
①分析图a,容器内通入少量水蒸气的作用是___________________。
②分析图b,ΔH3________0(填“>”、“<”或“=”),结合图a分析,T1=___________℃。
③分析图b,高于500℃后,曲线n发生的副反应热化学方程式为________________________________, 曲线n中HCl转化率明显降低的原因是____________________________________。
(3)①CaFeO4可制作半导体材料,向1L的高铁酸钠(Na2FeO4)溶液中加入0.0056g生石灰开始生成CaFeO4沉淀,原高铁酸钠溶液的物质的量浓度为________mol/L。已知Ksp(CaFeO4)=4.54×10-9,溶液体积变化忽略不计。
②用K2FeO4代替MnO2制备的碱性干电池(KOH做电解液)具有能量密度大、寿命长、无污染等优点,正极反应生成Fe2O3,写出正极的电极反应式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面所写的有机反应方程式及其类型都正确的是
A.  取代反应
取代反应
B. 2CH3CHO+ O2 → 2CH3COOH 氧化反应
C. CH2=CH2 + Br2 → CH3CHBr2 加成反应
D. HCOOH + CH3CH2OH ![]() HCOOCH3CH2+ H2O 取代反应
HCOOCH3CH2+ H2O 取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以钴以Co2O3CoO的形式存在,吸附在铝箔的单面或双面,锂混杂于其中.从该废料中回收(CoO) 的工艺流程如图: 
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 .
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的化学反应方程式为(产物中只有一种酸根) . 在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 .
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3 , 碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式 .
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是 .
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是(填序号).
A.c(Na+)=2c(CO32﹣)
B.c(Na+)>c(CO32﹣)>c(HCO3﹣)
C.c(OH﹣)>c(HCO3﹣)>c(H+)
D.c(OH﹣)﹣c(H+)=c(HCO3﹣)+2c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙能调节人体各系统生理功能,利用如图装置测定碳酸钙型补钙剂中钙的含量。已知氨基磺酸(H2NSO3H)俗称固体硫酸,在水溶液中为一元酸,广泛应用于锅炉水垢的清洗。
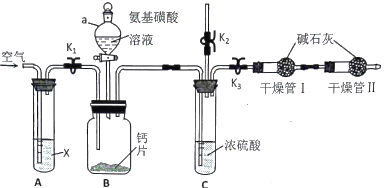
(1)A装置的作用为___________________,仪器a的名称为____________________。
(2)B 装置内发生反应的化学方程式为___________________________________,实验中不用盐酸与钙片反应的原因是_______________________________________。
(3)组装好仪器后,检查装置的气密性,接下来进行的操作是:打开K1、K2,关闭K3,通空气一段时间, ________________(填操作),打开仪器a活塞,滴入氨基磺酸溶液,待B装置中无气泡产生,关闭仪器a活塞。再次打开K1通空气一段时间,第二次通入空气目的是_______________________。如果不使用干燥管Ⅱ,测定结果____________(填“偏高”“偏低”“不变”)。
(4)取某补钙剂样品m克进行测定,测得干燥管Ⅰ在实验前后重量分别为m1克和m2克,则样品中钙的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,AgI饱和溶液中c(Ag+)为1.22×10﹣8 mol/L,AgCl的饱和溶液中c(Ag+)为1.25×10﹣5 mol/L.若在10mL含有KCl和KI各为0.01mol/L的溶液中,加入16mL 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是( )
A.c(K+)>c(NO3﹣)>c(Ag+)>c(Cl﹣)>c(I﹣)
B.c(K+)>c(NO3﹣)>c(Cl﹣)>c(Ag+)>c(I﹣)
C.c(K+)>c(NO3﹣)>c(Ag+)=c(Cl﹣)+c(I﹣)
D.c(NO3﹣)>c(K+)>c(Ag+)>c(Cl﹣)>c(I﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年,一档《辉煌中国》电视纪录片,让“厉害了,我的国”成了不少人的口头禅。我国科技创新成果卓越,下列成果中获得诺贝尔奖的是( )
A.侯德榜发明联合制碱法B.屠呦呦发现抗疟新药青蒿素
C.闵恩泽研发石油炼制催化剂D.张青莲主持测定了几种元素相对原子质量的新值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某可逆反应aA(s)+bB(g)cC(g)在一密闭的容器中达到平衡,如果t0时,改变某一外界条件,化学反应速率(v)﹣时间(t)图象如图所示.下列说法正确的是( )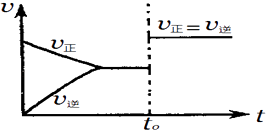
A.若a+b=c,则t0时可能是增大反应体系的压强
B.若a+b=c,则t0时不可能是加入催化剂
C.若a+b≠c,则t0时只可能是加入催化剂
D.若a+b≠c,则t0时有可能是增大反应体系的压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com