
| A. | 0.1mol/L NH4HCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/LHCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )>c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
分析 A.反应后溶质为碳酸铵和碳酸钠,二者浓度相等,由于氢氧根离子还来自水的电离,则c(HCO3- )<c(OH-);
B.反应后溶质为等浓度的醋酸、醋酸钠和NaCl,溶液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),结合物料守恒判断;
C.氨水为弱碱,则混合液中氨水过量,溶液呈碱性,则c(H+)<c(OH-),根据混合液中的电荷守恒判断;
D.反应后溶质为醋酸钠,根据醋酸钠溶液中的电荷守恒和物料守恒判断.
解答 解:A.反应生成等浓度的碳酸铵和碳酸钠,溶液呈碱性,由于氢氧根离子来自水的电离和碳酸根离子的水解,则c(HCO3-)<c(OH-),故A错误;
B.20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/L HCl溶液混合后,溶质为等浓度的醋酸、醋酸钠和NaCl,溶液呈酸性,说明醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(CH3COOH),根据物料守恒可知c(CH3COO-)>c(Cl-)>c(CH3COOH),溶液中离子浓度大小为:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B正确;
C.氨水为弱碱,则混合液中氨水过量,溶液呈碱性,则c(H+)<c(OH-),根据电荷守恒c(H+)+c(NH4+)=c(Cl-)+c(OH-)可知:c(Cl-)<(NH4+ ),所以c(Cl-)+c(H+)<c(NH4+ )>c(OH-),故C错误;
D.0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,恰好反应生成醋酸钠,溶液中满足物料守恒:c(CH3COOH)+c(CH3COO-)=c(Na+),还满足电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),二者结合可得:c(OH-)=c(H+)+c(CH3COOH),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握盐的水解原理、电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①③ | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 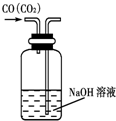 除去CO气体中的CO2气体 | B. | 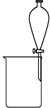 分 分离碘酒中的碘和酒精 | ||
| C. | 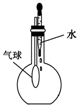 验证NH3的溶解性 | D. | 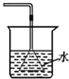 吸收HCl防倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
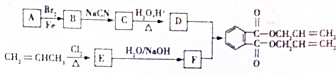
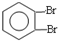 ,化合物E中所含的官能团名称为氯原子、碳碳双键.
,化合物E中所含的官能团名称为氯原子、碳碳双键.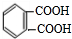 +2HOCH2CH=CH2$\stackrel{催化剂}{→}$
+2HOCH2CH=CH2$\stackrel{催化剂}{→}$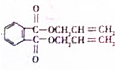 +2H2O,反应类型为酯化(取代)反应.
+2H2O,反应类型为酯化(取代)反应.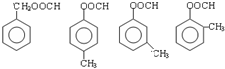 (其中一种).
(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
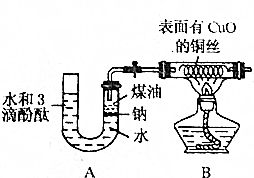 某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿加热铜丝.
某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿加热铜丝.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28gCO和N2混合气体中含有原子总数为2NA | |
| B. | 在1L1mol•L-1的氨水中含有NA个NH3分子 | |
| C. | 标准状况下,11.2LNO和11.2LO2混合后气体分子数为NA | |
| D. | 1mol Fe分别与足量Cl2、S反应,Fe失去电子数都为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com