
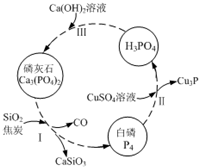
 氮、磷及其化合物在科研及生产中均有着重要的应用.
氮、磷及其化合物在科研及生产中均有着重要的应用.分析 (1)铁和过量稀硝酸反应生成硝酸铁、一氧化氮和水;
(2)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
由盖斯定律可知(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l);
(3)①依据发生反应2Ca3(PO4)2+6SiO2+10C→P4↑+6CaSiO3+10CO↑,判断CO的作用;
②依据氧化还原反应中铜元素、磷元素化合价变化计算;
③磷酸为三元酸与氢氧化钙反应,依据磷酸与氢氧化钙量不同,得到的产物可能是:Ca3(PO4)2、CaHPO4、Ca(H2PO4)2.
解答 解:(1)铁和过量稀硝酸反应生成硝酸铁、一氧化氮和水,反应的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
故答案为:Fe+4H++NO3-=Fe3++NO↑+2H2O;
(2)H2O(l)=H2O(g)△H1=44.0kJ•mol-1 (i)
N2(g)+O2(g)=2NO(g)△H2=229.3kJ•mol-1 (ii)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3=-906.5kJ•mol-1 (iii)
(iii)-(ii)×5-(i)×6得:4NH3(g)+6NO(g)=5N2(g)+6H2O(l),故△H4=-906.5-(229.3×5)-(44×6)=-2317kJ•mol-1,
故答案为:-2317;
(3)①步骤Ⅰ为白磷的工业生产方法之一,发生反应2Ca3(PO4)2+6SiO2+10C→P4↑+6CaSiO3+10CO↑,反应中C中的碳化合价升高,做还原剂;
故答案为:做还原剂;
②Cu元素的化合价由+2价降低到+1价,CuSO4是氧化剂,P4部分磷元素由0价降低到-3价,部分磷元素由0价升高到+5价,磷元素的化合价既升高又降低,所以P4既是氧化剂又是还原剂,若有11molP4参加反应,其中5mol的P4做氧化剂,60mol硫酸铜做氧化剂,只有6mol的P4做还原剂,则由电子守恒可知,有1 mol的CuSO4参加反应,则被硫酸铜氧化的白磷分子的物质的量为n则:n×4(5-0)=1mol×(2-1),解得n=$\frac{1}{20}$mol;=0.05mol
故答案为:0.05mol;
③磷酸为三元酸与氢氧化钙反应,依据磷酸与氢氧化钙量不同,得到的产物可能是:Ca3(PO4)2、CaHPO4、Ca(H2PO4)2;
故答案为:CaHPO4、Ca(H2PO4)2.
点评 本题依据N、P及其化合物的转化为情境考查了氧化还原反应的概念及有关计算,盖斯定律的应用,抓住氧化还原反应得失电子守恒是解题关键,题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验试液中的SO42-:试液$\stackrel{BaCl_{2}溶液}{→}$ 白色沉淀$\stackrel{HCl溶液}{→}$ 白色沉淀 | |
| B. | 检验试液中的Cl-:试液$\stackrel{稀H_{2}SO_{4}}{→}$无沉淀$\stackrel{AgNO_{3}溶液}{→}$ 白色沉淀 | |
| C. | 检验试液中的Fe2+:试液$\stackrel{氯水}{→}$无明显现象$\stackrel{KSCN溶液}{→}$血红色溶液 | |
| D. | 检验试液中的NH4+:试液$→_{供热}^{NaOH溶液}$气体逸出$→_{石蕊试纸}^{湿润的红色}$ 试纸变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
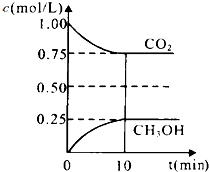 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、果糖、蔗糖和淀粉都能发生水解反应 | |
| B. | 利用油脂在碱性条件下的水解,可以制甘油和肥皂 | |
| C. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的高分子化合物 | |
| D. | 淀粉和纤维素的分子组成相同,它们之间互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子一定比原子大 | |
| B. | 所有原子的原子核都是由质子和中子构成 | |
| C. | 分子、原子、离子都是构成物质的粒子 | |
| D. | 物质状态发生变化,是因为粒子大小发生了变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com