

| m |
| M |
| 1.89g |
| 18g/mol |
| 0.22g |
| 44g/mol |
| ||
| 2.86g |
| (106+18x)g/mol |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
 某研究性学习小组在做Na2O2与水反应实验时,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此现象分别做了如下推测:
某研究性学习小组在做Na2O2与水反应实验时,发现Na2O2与水反应后的溶液中滴加酚酞试液溶液呈现红色,但红色很快褪色,甲、乙、丙三同学对此现象分别做了如下推测:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单糖是不能发生水解的最简单的糖类 |
| B、分子式符合Cn(H2O)m通式的物质,都是糖类物质 |
| C、淀粉、纤维素都是天然有机高分子化合物 |
| D、淀粉和纤维素都是由碳、氢、氧三种元素组成,两化合物中三元素的质量比相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物不可能存在非极性键 |
| B、离子键只存在于离子化合物中,不存在共价化合物中 |
| C、由极性键结合的分子不一定是极性分子 |
| D、极性分子中可能含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯水漂白和活性炭漂白的原理相同 |
| B、酒精对伤口进行消毒和重金属离子中毒原理相同 |
| C、用合成洗涤剂清洗油污和用纯碱溶液清洗油污的原理相同 |
| D、明矾净水和臭氧净水的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸铵溶液显中性,醋酸铵溶液中水电离的H+浓度大于10-7mol/L |
| B、NaHS溶液中:c(Na+)>c(HS-)>c(H+)>c(OH-) |
| C、NaH2PO4溶液中:c(Na+)>c(H3PO4)>c(H2PO4-)>c(H+)>c(OH-) |
| D、Kw表示的是水的电离平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为: 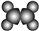 ③能与水在一定条件下反应生成醇 | ①由C、H两种元素组成; ②球棍模型为: 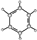 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com