
【题目】体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2 , 在相同温度下发生反应:2SO2+ O2 ![]() 2SO3 , 并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
2SO3 , 并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
A.等于p%
B.大于p%
C.小于p%
D.无法判断
【答案】B
【解析】反应:2SO2+ O2 ![]() 2SO3的正反应方向为气体体积减少的反应,对于乙容器来说,为保持体系内压强不变,即随反应的不断进行,容器体积不断减小,即相当于在甲容器反应的基础上增大压强,即平衡后,乙容器中SO2的转化率大于p%;
2SO3的正反应方向为气体体积减少的反应,对于乙容器来说,为保持体系内压强不变,即随反应的不断进行,容器体积不断减小,即相当于在甲容器反应的基础上增大压强,即平衡后,乙容器中SO2的转化率大于p%;
所以答案是:B
【考点精析】利用化学平衡状态本质及特征和化学平衡移动原理以及影响因素对题目进行判断即可得到答案,需要熟知化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动.


科目:高中化学 来源: 题型:
【题目】工业上可利用地沟油制备乙醇,乙醇再加工制备多种化工材料。

(1)A的结构简式为_____________________________。
(2)“反应I”的现象是__________________________。
(3)B的官能团名称为______________________。
(4)实验室合成草酸二乙酯的步骤为:如图,在a中加入10.6g无水乙醇、9.0g无水草酸、脱水剂甲苯、催化剂TsOH(有机酸)和2~3片碎瓷片,在74~76℃充分反应。a中所得混合液冷却后依饮用水、饱和碳酸钠溶液洗涤,再用无水硫酸钠干燥。减压蒸馏,得到草酸二乙酯12.8g。
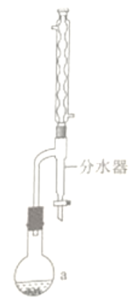
①仪器的名称是____,碎瓷片的作用是____________________________。
②合成过程最合适的加热方式是__________。
a.酒精灯直接加热 b.油浴 C.水浴 d.砂浴
③饱和碳酸钠溶液的作用是__________________________。
④合成草酸二乙酯的化学方程式为______________________________。
⑤草酸二乙酯的产率为____________________(保留小数点后一-位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别在等体积等pH或等物质的量浓度的盐酸和醋酸溶液中,加入足量锌粉,氢离子浓度c(H+)及氢气的体积V(H2)(同温同压下测定)的变化图示如下,其中正确的是 ( )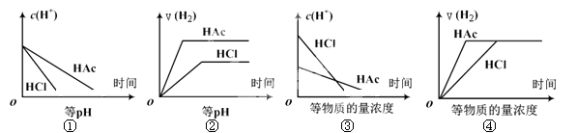
A.①②③
B.②④
C.①③
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 离子晶体不一定都含有金属元素
B. 离子晶体中除含离子键外,还可能含有其他化学键
C. 金属元素与非金属元素构成的晶体不一定是离子晶体
D. 熔化后能导电的晶体一定是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1,图2所示的实验。下列叙述中不正确的是( )
A.图1实验可通过观察产生气泡快慢来比较反应速率的大小
B.若图1所示实验中反应速率为①>②, 则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图2装置测定反应速率,可测定反应产生的气体体积及反应时间
D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是。
(2)该温度下,该反应的化学平衡常数是。
(3)若保持其他条件不变,用0.40 mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是。此时,该合成反应是否达到了平衡状态?(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。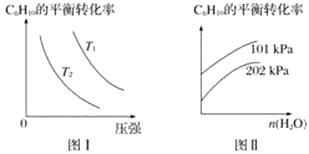
①由图Ⅰ可知,T1T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将(填“越大”、“越小”或“不变”),原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、钠混合物投入足量的水中,充分反应后,得到澄清溶液,并收集到4.48L氢气(标准状况),若钠的物质的量为0.1mol,则铝的物质的量为
A.0.2molB.0.1molC.0.05molD.0.025mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种:NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、SO42- , 现取两份100mL溶液进行如下实验: ①第一份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。②第二份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。以下推测不正确的是( )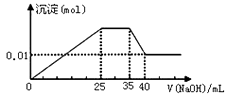
A.原溶液一定不存在Cu2+
B.不能确定原溶液是否含有K+
C.实验所加的NaOH的浓度为2mol·L-1
D.原溶液确定含Mg2+、Al3+、NH4+ , 且n(Mg2+) ∶n(Al3+)∶n( NH4+)=1∶1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com