
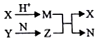
 ������Ԫ��A��B��C��D��ԭ��������������B��Dͬ���壻X��Y��N�ֱ�������������Ԫ���е�������ɵĻ����Z������������Ԫ����ɵĻ������X��YĦ��������ͬ��YΪ����ɫ���壬��������֮���ת����ϵ��ͼ��ʾ������������ʡ�ԣ���������˵����һ����ȷ���ǣ�������
������Ԫ��A��B��C��D��ԭ��������������B��Dͬ���壻X��Y��N�ֱ�������������Ԫ���е�������ɵĻ����Z������������Ԫ����ɵĻ������X��YĦ��������ͬ��YΪ����ɫ���壬��������֮���ת����ϵ��ͼ��ʾ������������ʡ�ԣ���������˵����һ����ȷ���ǣ�������| A�� | ��Է�������M��N���е�N��M | B�� | .�����Ӱ뾶��D��B��C��A | ||
| C�� | ZΪNa2CO3 | D�� | .ͼ��������������ԭ��Ӧ |
���� ������Ԫ��A��B��C��D��ԭ��������������X��Y��N�ֱ�������������Ԫ���е�������ɵĻ����YΪ����ɫ���壬��֪YΪNa2O2��Z������������Ԫ����ɵĻ������ZΪNaOH��NΪH2O����X��YĦ��������ͬ����֪XΪNa2S��MΪH2S�����ԭ��������B��Dͬ�����֪��AΪH��BΪO��CΪNa��DΪS���Դ������
��� �⣺������������֪��AΪH��BΪO��CΪNa��DΪS��
A��NΪH2O��MΪH2S����Է�������M��N��ˮ���Ӽ京�������е�ΪN��M����A����
B�����Ӳ�Խ�࣬���Ӱ뾶Խ������ͬ�����Ų�ʱԭ������������Ӱ뾶С��������Ӱ뾶��D��B��C��A����B��ȷ��
C��������������֪��ZΪNaOH����C����
D��ֻ�й���������ˮ�ķ�ӦΪ������ԭ��Ӧ����D����
��ѡB��
���� ���⿼��������ƶϼ�ԭ�ӽṹ��Ԫ�������ɣ�Ϊ��Ƶ���㣬����YΪ�������ơ�XΪ�������ƶ�����Ϊ���ؼ������ط������ƶ������Ŀ��飬ע��Ԫ�ػ�����֪ʶ��������֪ʶ��Ӧ�ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
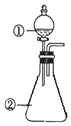 ����ͼ��ʾװ�ý�������ʵ�飺��������Һ������У�Ԥ���������ʵ��������ǣ�������
����ͼ��ʾװ�ý�������ʵ�飺��������Һ������У�Ԥ���������ʵ��������ǣ�������| ѡ�� | �������� | �������� | Ԥ����е����� |
| A | ϡ���� | ̼�������������ƵĻ����Һ | ������������ |
| B | Ũ���� | ��ɰֽ��ĥ�������� | ��������ɫ���� |
| C | �Ȼ�����Һ | Ũ����������Һ | ����������ɫ���� |
| D | ��������Һ | �������������Һ | ��Һ����ɫ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| n��CO��/mol | 1.0 | 0.70 | 0.45 | 0.25 | 0.10 | 0.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
 ������������Ҫ�ɷ�֮һ���ϳ���·��ͼ��
������������Ҫ�ɷ�֮һ���ϳ���·��ͼ��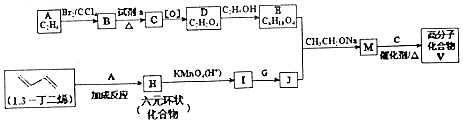
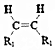 $\stackrel{KMnO_{4}/H+}{��}$2R1COOH
$\stackrel{KMnO_{4}/H+}{��}$2R1COOH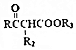 +R1OH
+R1OH CH3CH2OOC-COOCH2CH3+2H2O��
CH3CH2OOC-COOCH2CH3+2H2O�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | �����ĵ缫��ӦʽΪMg+2OH-+2e-�TMg��OH��2 | |
| B�� | ��طŵ�ʱ��OH-���ƶ� | |
| C�� | �������Һ������ϡH2SO4 | |
| D�� | �����ĵ缫��ӦʽΪ2MnO2+H2O+2e-�TMn2O3+2OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
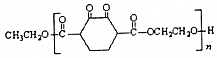
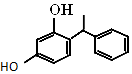 ��������Ѹ�٣��ߴ�ͦ�Σ������а���֮�ƣ���������һ���л���ṹ��ͼ��ʾ������˵��������ǣ�������
��������Ѹ�٣��ߴ�ͦ�Σ������а���֮�ƣ���������һ���л���ṹ��ͼ��ʾ������˵��������ǣ�������| A�� | ���л����������������� | |
| B�� | ����ʽΪC14H14O2 | |
| C�� | 1 mol����������ˮ��Ӧʱ���������2 mol��Br2 | |
| D�� | ���л�������Na2CO3��Һ��Ӧ�������ɵ�������ʹ����ʯ��ˮ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڱ�״���£�78g����̼̼˫����ĿΪ3NA | |
| B�� | 1mol�İ��ף�P4�������Ȼ�̼��CCl4���������Ĺ��۽�����Ϊ4NA | |
| C�� | 500mL2mol/LNH4NO3��Һ�У����е�ԭ����ĿΪ2NA | |
| D�� | ��⾫��ͭʱ����������������32g��������ת�Ƶĵ�����ЧĿһ��ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��ѧʽ | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
| Ksp��Ka | Ksp=1.8��10-10 | Ksp=2.0��10-12 | Ka=1.8��10-5 | Ka=3.0��10-8 | Ka1=4.1��10-7 Ka2=5.6��10-11 |
| A�� | ��Ũ�Ⱦ�Ϊ1��10-4 mol/L��KCl��K2CrO4���Һ����μ���1��10-3 mol/LAgNO3��Һ��CrO42-�ȳ�����10-5 mol/L�Ƿ�̫С�����Ũ��һ�㶼��Ϊ������ȫ�ˣ� | |
| B�� | H2CO3��HCO3-��CH3COO-��ClO-����Һ�п��Դ������� | |
| C�� | ��ͬŨ�ȵ�CH3COONa��NaClO�����Һ��������Ũ�ȵĴ�С��ϵΪ��c��Na+����c��CH3COO-����c��ClO-����c��OH-����c��H+�� | |
| D�� | ̼������Һ�еμ�������ˮ�����ӷ���ʽΪ��CO32-+Cl2+H2O�THCO3-+Cl-+HClO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
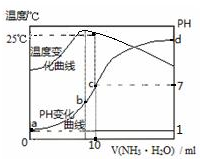
| A�� | n=1.0 | |
| B�� | ˮ�ĵ���̶ȣ�b��c��a��d | |
| C�� | c�㣺c��NH4+��=c��Cl-��=1.0mol•L-1 | |
| D�� | 25��ʱ��NH4Cl��ˮ�ⳣ����Kh��=��n-1����10-7 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com