
 △H=+230kJ?mol-1
△H=+230kJ?mol-1
 C(s)=
C(s)= CO2(g)+2Fe(s)△H=+230kJ?mol-1,
CO2(g)+2Fe(s)△H=+230kJ?mol-1, +②-③×
+②-③× 可得到2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s);
可得到2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s); C(s)=
C(s)= CO2(g)+2Fe(s)△H=+230kJ?mol-1,
CO2(g)+2Fe(s)△H=+230kJ?mol-1, +②-③×
+②-③× 可得到2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s),
可得到2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s), +(+230kJ?mol-1)-(-390kJ?mol-1)×
+(+230kJ?mol-1)-(-390kJ?mol-1)× =-600kJ/mol,
=-600kJ/mol,

科目:高中化学 来源:2012届福建省四地六校高三第三次月考化学试卷 题型:填空题
(10分)铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化亚铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0
①该反应的平衡常数表达式为:K=
②该温度下,在2L盛有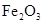 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
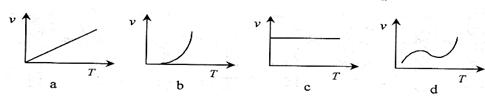
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)
和温度(T)的关系示意图中与铝热反应最接近的是 。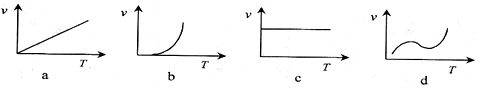
(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性。但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列方程式:
Fe(OH)3 + ClO- + == FeO42- + Cl- + ;
(4)若将ag Fe和Al的混合物溶于2mol/L的足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为
查看答案和解析>>
科目:高中化学 来源:2013届福建省三明九中高三上学期第二次月考化学试卷(带解析) 题型:填空题
(10分)铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)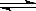 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0
①该反应的平衡常数表达式为:K=
②该温度下,在2L盛有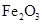 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是 。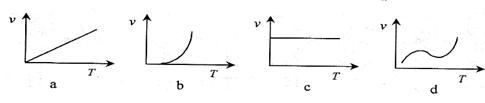
(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性。但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列方程式:
Fe(OH)3 + ClO- + == FeO42- + Cl- + ;
(4)若将ag Fe和Al的混合物溶于2mol/L的足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省高三上学期第二次月考化学试卷(解析版) 题型:填空题
(10分)铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g)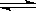 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0
①该反应的平衡常数表达式为:K=
②该温度下,在2L盛有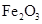 粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是 。
(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性。但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列方程式:
Fe(OH)3 + ClO- + == FeO42- + Cl- + ;
(4)若将ag Fe和Al的混合物溶于2mol/L的足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为
查看答案和解析>>
科目:高中化学 来源:2011-2012学年天津市高三寒假验收考试化学试卷 题型:填空题
(8分)铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:

①该反应的平衡常数表达式为:K= 。
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为 。
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是 。

(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性。但Fe3+只有在碱性介质中才能被氧化为FeO2-4,请完成下列方程式:

(4)若将ag Fe和Al的混合物溶于2mol/L的足量的硫酸中,将往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤.洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中A1的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:福建省月考题 题型:填空题
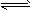 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0 

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com