
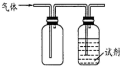
 用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | X | 酸性高锰酸钾溶液 | 溶液褪色 | X一定SO2 |
| B | NH3 | 酚酞试液 | 溶液变为红色 | 氨水呈碱性 |
| C | NO2 | KI-淀粉溶液 | 溶液变为蓝色 | NO2有还原性 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.还原性气体能使酸性高锰酸钾溶液褪色;
B.氨气的密度比空气的小,应利用向下排空气法收集;
C.二氧化氮与水反应生成硝酸,可氧化KI生成碘单质;
D.氯气与水反应生成盐酸和HClO,均为酸,且HClO具有漂白性.
解答 解:A.还原性气体能使酸性高锰酸钾溶液褪色,不一定是二氧化硫,故A错误;
B.氨气的密度比空气的小,应利用向下排空气法收集,图中收集气体的装置不合理,故B错误;
C.氧化氮密度比空气大,与水反应生成硝酸,可氧化KI生成碘单质,碘遇淀粉变蓝,NO2有氧化性,故C错误;
D.氯气与水反应生成盐酸和HClO,均为酸,且HClO具有漂白性,结论应为氯气与水反应生成物具有酸性,HClO具有漂白性,故D正确.
故选D.
点评 本题综合考查物质的性质检验,为高考常见题型,侧重于学生的分析能力、实验能力的考查,注意把握物质的性质以及实验的严密性、可行性的评价,难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 一定条件下6.4g S02与足量氧气反应生成S03,转移电子数小于0.2 NA | |
| C. | lmol羟基(一OH)与17gNH3所含电子数都为NA | |
| D. | 适量铜粉溶解于1 L 0.5mol/L稀硝酸中,当生成2.24 L NO时,溶液中氮原子数0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜晶体、雾 | B. | 水煤气、氢氧化铁胶体 | ||
| C. | 盐酸、磷酸钙 | D. | 玻璃、含Fe为70%的氧化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可向海水中加入明矾使海水淡化从而解决淡水供应危机 | |
| B. | 福尔马林可用于浸制标本,是因为其能使蛋白质变性 | |
| C. | 应用酒精的浓度通常为75% | |
| D. | 向烟花中添加含钠、钙、铜等金属元素的化合物可在燃烧时产生绚丽缤纷的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2 mol SO3含有的氧原子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32-)=1 mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1 L溶液,所得溶液中Na+的浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取反应后的固体放入试管中,… |
| SO2被氧化的程度 | V与m1或m2的关系 |
| 完全被氧化 | V=0 |
| 部分被氧化 | 0<V<$\frac{7{m}_{1}}{30}$或m1>$\frac{30V}{7}$ |
| 未被氧化 | V=$\frac{7{m}_{1}}{30}$或m1=$\frac{30V}{7}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2气体使高锰酸钾溶液褪色,体现了SO2的漂白性 | |
| B. | 在AgNO3的溶液中加入锌粉,能置换出银,说明AgNO3的还原性比Zn(NO3)2强 | |
| C. | 浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸 | |
| D. | 浓硫酸放入蔗糖中,能使蔗糖碳化,说明浓硫酸具有强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com