
(14分)2SO2(g)+O2(g) 2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
2SO3(g)是生产硫酸的主要反应之一。下表是原料气按
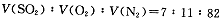 投料,在
投料,在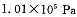 时,不同温度下SO2的平衡转化率。
时,不同温度下SO2的平衡转化率。

(1)该反应是_ 反应(填“放热”或“吸热”)。
(2)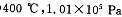 时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
时,将含10 mol SO2的原料气通入一密闭容器中进行反应平衡时SO2的物质的量是 mol。
(3)硫酸厂尾气(主要成分为SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若尾气中SO2与氨水恰好反应得到弱碱性的(NH4)2SO3溶液,则有关该溶液的下列关系正确的是 (填序号)。
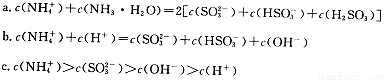
②用MnO2与水的悬浊液吸收上述尾气并生产MnSO4
i.得到MnSO4的化学方程式是
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2的吸收率与溶液pH的关系如图乙。

图甲中pH变化是因为吸收中有部分SO2转化为H2SO4生成H2SO4反应的化学方程式是____;由图乙可知pH的降低 SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是 。
(14分)
(1)放热
(2)0.08
(3)①ac
②i.H2O+SO2 H2SO3 MnO2+ H2SO3= MnSO4+H2O(或MnO2+ SO2= MnSO4)
H2SO3 MnO2+ H2SO3= MnSO4+H2O(或MnO2+ SO2= MnSO4)
ii.2SO2+2H2O+ O2=2 H2SO4
不利于 溶液中存在H2O+SO2 H2SO3
H2SO3 H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
【解析】
试题分析:(1)温度升高二氧化硫的转化率降低,说明升高温度平衡逆向移动,所以正向为放热反应;
(2)该条件下二氧化硫的转化率为99.2%,所以10 mol SO2的原料气平衡时剩余10×(1-99.2%)=0.08mol SO2
(3)①根据物料守恒规律,c(NH4+)+c(NH3·H2O)=2c(H2SO3)+2c(SO32-)+ 2c(HSO3-),a正确;b不符合电荷守恒规律,错误;(NH4)2SO3溶液为碱性溶液,说明SO32-的水解程度大于NH4+的水解程度,所以溶液中离子浓度的大小关系是c(NH4+)>c(SO32-)>c(OH-)>c(H+),c正确;答案选ac;
②i.二氧化硫与水反应生成亚硫酸,亚硫酸与二氧化锰发生氧化还原反应生成硫酸锰,化学方程式为H2O+SO2 H2SO3 MnO2+ H2SO3= MnSO4+H2O;
H2SO3 MnO2+ H2SO3= MnSO4+H2O;
ii.SO2与水、氧气反应生成硫酸,化学方程式为2SO2+2H2O+ O2=2 H2SO4;由乙图可知,pH减小,二氧化硫的吸收率下降,所以pH的降低不利于SO2的吸收;因为二氧化硫溶于水后存在平衡H2O+SO2 H2SO3
H2SO3 H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
H++ HSO3-,当溶液中酸性增强,平衡向左移动,使二氧化硫从体系中逸出。
考点:考查反应的能量变化,化学平衡的移动,溶液中离子浓度的大小比较,化学方程式的判断与书写


科目:高中化学 来源:2013-2014北京市丰台区高三二模理综化学试卷(解析版) 题型:简答题
(15分)
某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
操作 | 现象 |
|
|
b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
① 碳与浓硝酸的反应,说明浓硝酸具有 性。
② 反应产生的热量会使少量浓硝酸受热分解,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。同学甲认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验。
Ⅰ.制取NO2气体。
① 在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
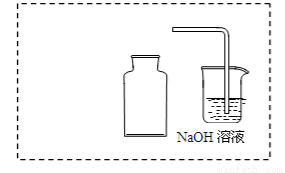
② NaOH溶液的作用是吸收多余的NO2,该反应生成两种物质的量相等的正盐,写出反应的化学方程式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
① 根据实验现象写出碳与NO2气体反应的化学方程式 。
② 试分析是否需要增加带火焰的木炭与纯净的X气体反应的实验 。
③ 通过实验探究,你认为甲、乙同学的预测是否合理,请简述理由 。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市丰台区高三二模理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.蛋白质及其水解产物都具有两性
B.淀粉和油脂都是可水解的高分子化合物
C.鸡蛋清溶液中加入饱和Na2SO4溶液有沉淀生成是因为蛋白质变性
D.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三第二学期综合练习二理综化学试卷(解析版) 题型:选择题
常温时,下列叙述正确的是
A.pH=9的NH4Cl与NH3·H2O混合溶液中c(Cl-)>c(NH4+)
B.pH=2.5的可乐中c(H+)是pH=3.5的柠檬水中c(H+)的1 0倍
C.AgCl在0.1 mol/L CaCl2溶液和0.l mol/L NaCl溶液中的溶解度相同
D.1 mL l mol l L Na2CO3溶液加水稀释至100 mL,pH和Kw均减小
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三二模理综化学试卷(解析版) 题型:简答题
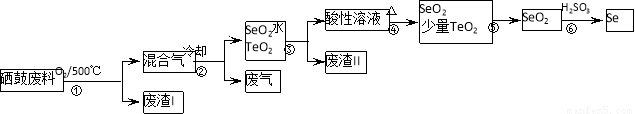
(14分)硒(34Se)和碲(52Te)都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下:
已知:
物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
TeO2 | 733℃ | 1260℃ | 450℃ | 微溶于水 |
(1)Se的氢化物的电子式是______。
(2)步骤①中通入的氧气使硒鼓废料翻腾,目的是______。
(3)废气的主要成分是______;废渣II的主要成分是______。
(4)步骤④中主要反应的化学方程式是______;步骤⑥反应的化学方程式是______。
(5)根据表中数据,步骤⑤最适宜的分离方法是______。
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:选择题
下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是
A.NH4+、K+、Cl-、OH- B.H+、Fe2+、MnO4-、Cl-
C.Ba2+、Na+、NO3-、SO42- D.Na+、H+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省红河州高三下学期毕业生复习统一检测理综化学试卷(解析版) 题型:填空题
(14分)2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
② H2(g)+
H2(g)+  F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
③H2(g)+  O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g)  2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
A.容器内颜色保持不变 B. 2v逆(NO)=v正(O2)
C.容器内压强保持不变 D.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C2H4 | B.C2H6O | C.C2H6O2 | D.C3H6O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com