
【题目】已知分解1 mol 液态H2O2 ,生成液态H2O和氧气放出热量98kJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2(l)+ I-(aq) ![]() H2O(l) +IO-(aq) △H1 反应Ⅰ
H2O(l) +IO-(aq) △H1 反应Ⅰ
H2O2(l)+ IO-(aq)![]() H2O(l) +O2(g)+ I-(aq)△H2 反应Ⅱ
H2O(l) +O2(g)+ I-(aq)△H2 反应Ⅱ
下列有关说法错误的是( )
A. 可以用带火星的木条检验H2O2是否开始分解
B. IO-在反应Ⅰ中是氧化产物,在反应Ⅱ中是氧化剂
C. 在H2O2溶液中加入NaIO也能提高H2O2分解速率
D. △H1+△H2 ![]() -98kJ/mol
-98kJ/mol
【答案】D
【解析】A.反应生成了氧气,可以用带火星的木条检验H2O2是否开始分解,故A正确;B. 根据H2O2(l)+ I-(aq) =H2O(l)+IO-(aq),IO-在反应Ⅰ中是氧化产物,在反应ⅡH2O2(l)+IO-(aq)=H2O(l)+O2(g)+I-(aq)中IO-是氧化剂,故B正确;C.根据反应Ⅱ在H2O2溶液中加入NaIO反应生成了I-,由反应H2O2(l)+I-(aq)=H2O(l)+IO-(aq)和H2O2(l)+IO-(aq) ═H2O(l)+O2(g)+I-(aq)可知,I-是H2O2分解反应的催化剂,能提高H2O2分解速率,故C正确;D.根据盖斯定律可知,Ⅰ+Ⅱ可得,2H2O2(l)═2H2O(l)+O2(g)△H=△H1+△H2=-196kJ/mol,故D错误;故选D。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】下列反应属于氮的固定的是( )
A.空气在雷电作用下产生一氧化氮B.一氧化氮和氧气反应生成二氧化氮
C.铜与浓硝酸反应产生二氧化氮D.氯化铵与氢氧化钙反应生成氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向体积相同、浓度均为0.1 mol/L的MOH、ROH两种碱溶液中不断加水稀释,溶液的pH与溶液浓度的对数(lgc)间的关系如图。下列说法错误的是

A. Kb(MOH)的数量级为10-5
B. a、b两点溶液中,水的电离程度:a<b
C. 等体积等浓度的ROH和MCl混合后所得溶液中:c(OH-)>c(H+)
D. 用相同浓度的盐酸分别中和a、b两点溶液,消耗盐酸体积:Va>Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
A.等物质的量的N2和CO所含分子数均为NA
B.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-的个数为NA
C.1mol OH- 和17g NH3 所含的电子数相等
D.在常温常压下,11.2 L N2 所含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列微粒中,只有氧化性的是_____________ (用字母填写,下同),既有氧化性又有还原性的是___________________。
A. Cl2 B. S2— C. H+ D. Na E. FeCl2
(2)在4HCl(浓)+MnO2 ![]() MnCl2+Cl2↑+2H2O反应中
MnCl2+Cl2↑+2H2O反应中
①氧化剂是________,氧化产物是________;
②被氧化与未被氧化的HCl的质量之比为_______,若有7.3gHCl被氧化,转移电子的物质的量为________;。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.光导纤维是以二氧化硅为主要原料制成的
B.二氧化硅溶于水生成硅酸
C.石英、水晶、玛瑙的主要成分都是二氧化硅
D.二氧化硅是一种熔沸点很高、硬度很大的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.用三氯化铁溶液制取Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
B.碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
C.铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.碳酸氢钙溶液和足量氢氧化钠溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。
(1)上述反应中氧化剂是_____。
(2)根据上述反应,鉴别 NaNO2 和 NaCl。可选用的物质有①水、②碘化钾淀粉试纸③淀粉、④白酒、⑤食醋,你认为必须选用的物质有_____(填序号)。
(3)请配平以下化学方程式:______
![]() Al+
Al+![]() NaNO3+
NaNO3+![]() NaOH=
NaOH=![]() NaAlO2+
NaAlO2+![]() N2↑+
N2↑+![]() H2O
H2O
若反应过程中转移 5 mol 电子,则生成标准状况下 N2 的体积为_____L。
Ⅱ.“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成 VO2+。
(4)请写出金属钒与浓硝酸反应的离子方程式:_____。
(5)V2O5 是两性氧化物,与强碱反应生成钒酸盐(阴离子为 VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出 V2O5 分别与烧碱溶液和稀硫酸反应生成的盐的化学式:_____、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用如图所示装置模拟工业上生产无水FeCl2的过程。
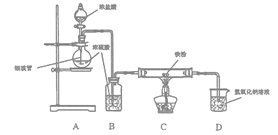
下列说法中正确的是
A. 先点燃C处酒精灯,再打开分液漏斗的活塞
B. 本实验中浓H2SO4体现出吸水性和强氧化性
C. 利用该装置制备FeCl2的原理可表示为:Fe+2HCl![]() FeCl2+H2
FeCl2+H2
D. 装置D适合处理该实验的所有尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com