
| 0.02mol/L |
| 0.03mol/L |
| [N2O4] |
| [NO2]2 |
| 0.01mol/L |
| (0.01mol/L)2 |


 ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д� �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| a |
| 200b |
| a |
| 200b |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ɽ��ʡ��������Ӣ��ʵ��ѧУ������ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
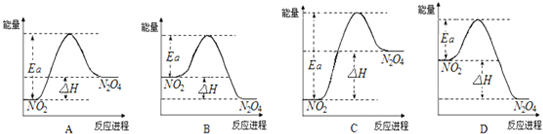
��11�֣���֪N2O4 (g)  2NO2 (g) ��H<0��
2NO2 (g) ��H<0��
��1���ֽ�1 mol N2O4 ����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����________��
��2��������ͬ�¶��£�������Ӧ�������Ϊ1L�ĺ����ܱ������н��У�ƽ�ⳣ��________������������䡱��С�� ������Ӧ3s��NO2�����ʵ���Ϊ0.6mol����0~3s�ڵ�ƽ����Ӧ����v��N2O4��=________mol��L-1��S-1��
��3��NO2���ð�ˮ��������NH4NO3��25��ʱ����amol NH4NO3����ˮ����Һ�����ԣ�ԭ���� �������ӷ���ʽ��ʾ���������Һ�μ�bL��ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ����е�ˮ�ĵ���ƽ�⽫______������������������ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�꽭��ʡ�߰���ѧ�߶���ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
����12�֣��������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӡ�
��.Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽���÷�Ӧԭ������������ʵ�飬�����Ϊ1L���ܱ������У�����1mol CO2��3.25 mol H2����һ�������·�����Ӧ���ⶨCO2��CH3OH(g)��H2O(g)��Ũ����ʱ��仯����ͼ��ʾ��
��1���ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ���� �� mol/(L��min)
�� mol/(L��min)
��2����������CO2��ת����Ϊ ��
��3�����д�ʩ����ʹn(CH3OH)/n(CO2)������� ��
| A�������¶� | B������ʱ���뵪�� |
| C����ˮ��������ϵ�з��� | D���ø���Ч�Ĵ��� |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�콭��ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
����12�֣��������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӡ�
��.Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽���÷�Ӧԭ������������ʵ�飬�����Ϊ1L���ܱ������У�����1mol CO2��3.25 mol H2����һ�������·�����Ӧ���ⶨCO2��CH3OH(g)��H2O(g)��Ũ����ʱ��仯����ͼ��ʾ��

��1���ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ���� �� mol/(L��min)
�� mol/(L��min)
��2����������CO2��ת����Ϊ ��
��3�����д�ʩ����ʹn(CH3OH)/n(CO2)������� ��
A�������¶� B������ʱ���뵪��
C����ˮ��������ϵ�з��� D���ø���Ч�Ĵ���
��.��ͼ��һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫һ����ʯī�缫��һ�������缫������ʱM��N�����缫�������������٣���ش��������⣺

��1��M���ĵ缫����Ϊ ��
��2�������Ҵ��IJ��缫�ĵ缫��ӦʽΪ ��
��3���ڴ˹������ҳ���ijһ�缫����������4.32gʱ����ʱ�ҳ���Һ�����Ϊ400mL�����ҳ�����Һ��pHΪ ��
��4�����ڳ��³�ѹ�£�1g C2H5OHȼ������CO2��Һ̬H2Oʱ�ų�29.71kJ��������ʾ�÷�Ӧ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ɽ��ʡ������ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��11�֣���֪N2O4 (g)  2NO2 (g) ��H<0��
2NO2 (g) ��H<0��
��1���ֽ�1 mol N2O4 ����һ��ѹ�ܱ������У�����ʾ��ͼ��ȷ����˵����Ӧ�ﵽƽ��״̬����________��

��2��������ͬ�¶��£�������Ӧ�������Ϊ1L�ĺ����ܱ������н��У�ƽ�ⳣ��________������������䡱��С�� ������Ӧ3s��NO2�����ʵ���Ϊ0.6mol����0~3s�ڵ�ƽ����Ӧ����v��N2O4��=________mol��L-1��S-1��
��3��NO2���ð�ˮ��������NH4NO3��25��ʱ����amol NH4NO3����ˮ����Һ�����ԣ�ԭ���� �������ӷ���ʽ��ʾ���������Һ�μ�bL��ˮ����Һ�����ԣ���μӰ�ˮ�Ĺ����е�ˮ�ĵ���ƽ�⽫______������������������ƶ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com