
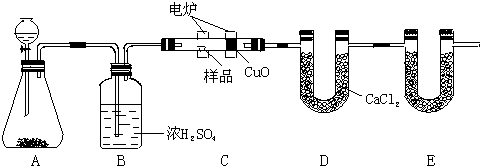
分析 先明确各装置的作用:A用来制取反应所需的氧气、B用来吸收水、C是在电炉加热时用纯氧气氧化管内样品、D用来吸收产生的水、E用于测量二氧化碳的含量;
(1)双氧水可分解生成氧气,A装置中分液漏斗盛放的物质是双氧水,化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2;
(3)E装置的作用为测量燃烧生成的二氧化碳的质量;
(4)装置B用于干燥氧气,避免氧气中水分进入有机物燃烧装置发生危险,且影响有机物中氢元素的测定;
(5)根据E中增加的为二氧化碳的质量、D中增加的为水的质量计算出C、H元素质量,再根据总质量确定是否含有氧元素,最后计算出该有机物的最简式;
(6)碱石灰能够吸收空气中的二氧化碳和水分,影响测定结果,需要在E装置后增加一个干燥管.
解答 解:(1)双氧水可分解生成氧气,A装置中分液漏斗盛放的物质是双氧水,化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)有机物燃烧产物中会有部分CO,CuO的作用是使有机物充分氧化生成CO2和H2O,故答案为:使有机物充分氧化生成CO2和H2O;
(3)E装置中所盛放物质最好选用碱石灰或氢氧化钠,因为氢氧化钠可以完全吸收反应生成的二氧化碳.故填碱石灰或氢氧化钠,它的作用是吸收CO2气体,
故答案为:碱石灰或氢氧化钠;吸收CO2气体;
(4)若将B装置去掉,A中生成的氧气中含有水蒸气进入D装置,导致造成测得有机物中含氢量增大,
故答案为:造成测得有机物中含氢量增大;
(5)本实验需测定有机物中碳元素、氢元素的质量,原理是根据氢氧化钠吸收的二氧化碳的质量求碳元素的质量,有机物燃烧时可能也产生一氧化碳,为了测定精确,要将有机物不完全燃烧产生的少量CO氧化成CO2,氧化铜通过与一氧化碳反应能保证有机物中的碳都转化为CO2;根据硫酸铜吸收的水的质量求氢元素的质量,然后根据碳、氢元素的质量和是否等于1.2克确定是否含有氧元素.过程如下:
E管质量增加1.76克说明生成了1.76克二氧化碳,可得C元素的质量:1.76g×$\frac{12}{44}$×100%=0.48g;
D管质量增加0.72克说明生成了0.72克水,可得H元素的质量:0.72g×$\frac{2}{18}$×100%=0.08g;
从而可推出含O元素的质量为:1.2-0.48-0.08=0.64g,
设最简式为CXHYOZ,则:12X:Y:16Z=0.48:0.08:0.64,
则X:Y:Z=1:2:1,所以该有机物的最简式为:CH2O,
故答案为:CH2O;
(6)碱石灰中的二氧化碳和水分能够被碱石灰吸收,影响测定结果,从定量测定准确角度去考虑,该装置的改进方法为:在E后再连一个干燥管,防止空气中的CO2和H2O,故答案为:在E后再连一个干燥管,防止空气中的CO2和H2O.
点评 本题是一道较综合的实验题,主要考查学生运用所学化学知识综合分析和解决实际问题的能力;增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 16 | B. | 14 | C. | 12 | D. | 28 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)合成氨工业对国民经济和社会发展具有重要的 意义.某合成氨工业中氢气由天然气和水反应制备,其主要反应为:CH4(g)+2H2O (g)?CO2(g)+4H2(g)反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)
(1)合成氨工业对国民经济和社会发展具有重要的 意义.某合成氨工业中氢气由天然气和水反应制备,其主要反应为:CH4(g)+2H2O (g)?CO2(g)+4H2(g)反应过程中能量变化如图所示,则该反应为吸热反应(填“吸热”或“放热”)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =CHCOOCH2CH3)的路线如下:
=CHCOOCH2CH3)的路线如下:
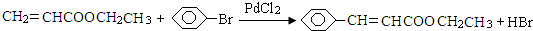


 )与化合物DCH3COOCH2CH3发生反应,可直接合成有机物Q.则D的结构简式为CH3COOCH2CH3,化合物C名称为苯甲醛.
)与化合物DCH3COOCH2CH3发生反应,可直接合成有机物Q.则D的结构简式为CH3COOCH2CH3,化合物C名称为苯甲醛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
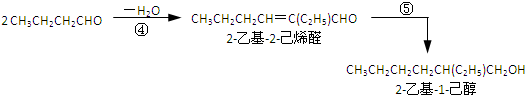
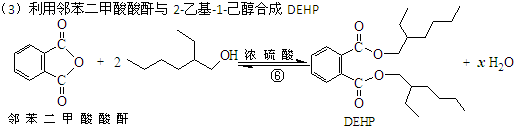
| A. | 合成过程涉及加成、消去、酯化、聚合等类型的有机反应 | |
| B. | 步骤(1)中②反应发生的条件是在NaOH/醇溶液中加热,反应类型是消去反应 | |
| C. | 步骤(1)(2)连续操作时,③、⑤消耗H2物质的量相等 | |
| D. | ⑥反应方程式中产物H2O系数x=2,及时除去⑥中反应釜内的水可提高DEHP产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
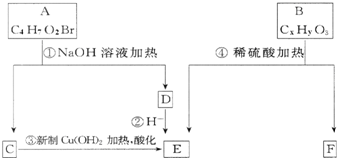 Ⅰ.已知一个碳原子上连有两个羟基时,易发生下列转化.
Ⅰ.已知一个碳原子上连有两个羟基时,易发生下列转化. $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$
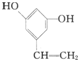 或
或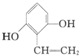
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20℃0.1mol•L-1的盐酸溶液20 mL与0.5g块状碳酸钙反应 | |
| B. | 20℃0.2mol•L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应 | |
| C. | 10℃0.2mol•L-1的盐酸溶液10mL与0.5g粉状碳酸钙反应 | |
| D. | 10℃0.1mol•L-1的盐酸溶液20 mL与1g块状碳酸钙反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com