
【题目】在强热条件下,硫酸亚铁固体可发生如下反应:2FeSO4![]() Fe2O3+SO2↑+SO3↑。若将此反应生成的气体先通入足量BaCl2溶液,再通入品红溶液中,则可能的现象为( )
Fe2O3+SO2↑+SO3↑。若将此反应生成的气体先通入足量BaCl2溶液,再通入品红溶液中,则可能的现象为( )
①BaCl2溶液中无沉淀析出;
②析出BaSO3沉淀;
③析出BaSO4沉淀;
④品红溶液褪色;
⑤品红溶液不褪色;
A.①④B.②④C.②③⑤D.③④
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.78 g苯和乙炔的混合物中含有碳氢键数目为6NA
B.100 g 46%的乙醇水溶液中含NA个氧原子
C.2.24 L氯气溶于足量NaOH溶液中,转移电子数为0.1NA
D.1 L 1mol·L-1CH3COONa溶液中醋酸根离子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室制取乙酸乙酯的主要步骤如下:

①配制3 mL乙醇、2 mL浓硫酸和2 mL乙酸的混合溶液。
②按如图连接好装置并加入混合液,用小火均匀加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置分层。
④分离出乙酸乙酯,洗涤、干燥。
请回答:
(1)装置中球形干燥管,除起到导气冷凝作用外,另一重要作用________
(2)步骤②安装好实验装置,加入药品前还应检查________
(3)写出制取乙酸乙酯的化学方程式:________
(4)上述实验中饱和碳酸钠溶液的作用是_________(填字母)。
a 中和乙酸并吸收乙醇 b 中和乙酸和乙醇
c 减少乙酸乙酯的溶解 d 加速酯的生成,提高其产率
(5)步骤③试管乙振荡前后所观察到的现象是_______;从试管乙中分离出乙酸乙酯的实验操作名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用盐桥电池从某些含碘物质中提取碘的两个装置,下列说法中正确的是( )
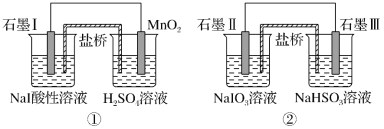
A.两个装置中,石墨I和石墨Ⅱ均作负极
B.碘元素在装置①中被还原,在装置②中被氧化
C.装置①中MnO2的电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D.装置①、②中的反应生成等量的I2时,导线上通过的电子数之比为1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列有关物质的量的计算
(1)![]() 个
个![]() 分子的物质的量是________
分子的物质的量是________![]() 。
。
(2)标准状况下,![]() 的体积是_________L。
的体积是_________L。
(3)含有相同氧原子数的![]() 和
和![]() ,其分子的质量比为_________。
,其分子的质量比为_________。
(4)标准状况下,![]() 气体溶于水配制成
气体溶于水配制成![]() 溶液,其物质的量浓度为_______
溶液,其物质的量浓度为_______![]() 。
。
(5)![]() 碳在一定量的氧气中完全燃烧,反应后生成
碳在一定量的氧气中完全燃烧,反应后生成![]() 和
和![]() 混合气体的平均摩尔质量是
混合气体的平均摩尔质量是![]() ,则生成的
,则生成的![]() 的质量是_____
的质量是_____![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼化钒(VB2)空气电池是目前储电能力最高的电池,电池示意图如图,该电池工作时发生的反应为:4VB2+11O2=4B2O3+2V2O5。下列说法不正确的是( )
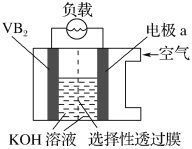
A.电极a为电池正极
B.电池工作过程中,电极a附近区域pH减小
C.图中选择性透过膜为阴离子透过膜
D.VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质检验的实验,结论正确的是( )
实验操作 | 现象 | 实验结论 | |
A | 向某溶液中加入硝酸酸化的氯化钡溶液 | 生成白色沉淀 | 溶液中一定含有 |
B | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
C | 往某溶液中加入KSCN溶液 | 显血红色 | 溶液中一定含有Fe3+ |
D | 往某溶液中加入盐酸 | 产生无色气体 | 溶液中一定含有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】6.4g铜投入一定浓度的HNO3中,铜完全溶解,生成NO和NO2的混合气体,用试管全部收集,得到标准状况下的体积为2240mL。请回答:
(1)反应中消耗掉HNO3的物质的量为___mol。
(2)生成NO2的体积(标况)为___mL。
(3)将盛有混合气体的试管倒扣在水槽中,通入标况下的O2,恰好使气体完全溶于水中,则通入O2的体积是___mL。(请写出解答过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:____________。
(2)实验室中用过氧化氢制取氧气的化学方程式为_______________,当生成标准状况下2.24L O2时,转移电子为______ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在其水溶液中的电离方程式:______。(只写第一步)
(4)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确:___________
Ⅱ.工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
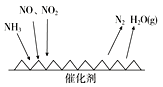
(1)由上图可知SCR技术中的氧化剂为________。
(2)用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1∶1时,写出该反应的化学方程式:________________________________
Ⅲ.研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应①:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.6 kJ/mol
CH3OH(g)+H2O(g) △H1= -49.6 kJ/mol
反应②:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2= +23.4 kJ/mol
2CH3OH(g) △H2= +23.4 kJ/mol
反应③:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=___________kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=___________kJ/mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com