
【题目】(1)标准状况下,与5.6L的CH4气体含相同H原子数的硫化氢的质量为___g。
(2)将2mol·L-1Al2(SO4)3和0.2mol·L-1H2SO4溶液等体积混合(设混合溶液体积等于两溶液体积之和),计算混合液中c(SO42-)=__mol·L-1。若用容量瓶以质量分数为98%、密度为1.84g/cm3的浓硫酸,配制480mL浓度成0.2mol·L-1 稀硫酸,计算需要量取____mL的浓硫酸。
(3)配平以下方程式___
___K2Cr2O7+___HCl=___KCl+___CrCl3+___Cl2↑+___H2O
上述反应中物质氧化性:___>__,每生成lmolCl2时有__个电子发生转移,氧化剂与还原剂的物质的量之比为__。
【答案】17g 3.1mol/L 5.4mL 1K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2 K2Cr2O7 Cl2 1.204×1024或2NA 1:6
【解析】
⑴先将甲烷物质的量算出来,再根据氢原子数算出硫化氢的物质的量,
⑵硫酸根浓度等于混合前各物质的硫酸根的物质的量除以溶液总体积,
先求算硫酸的浓度,在根据稀释原理计算需要浓硫酸的体积,
⑶先根据化合价升降原理进行配平,再分析氧化剂和还原剂。
⑴标准状况下,5.6L的CH4气体物质的量为![]() ,氢原子物质的量为0.25 mol×4 = 1 mol,含1 molH原子数的硫化氢的物质的量为0.5 mol,其质量为
,氢原子物质的量为0.25 mol×4 = 1 mol,含1 molH原子数的硫化氢的物质的量为0.5 mol,其质量为![]() ,
,
故答案为17;
⑵将2mol·L-1Al2(SO4)3和0.2mol·L-1H2SO4溶液等体积混合(设混合溶液体积等于两溶液体积之和),设体积为V L,计算混合液中c(SO42-)为 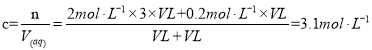 ,
,
若用容量瓶以质量分数为98%、密度为1.84g/cm3的浓硫酸,
物质的量浓度为![]()
配制480mL浓度成0.2mol·L-1 稀硫酸,将溶液稀释成500 mL,根据
![]() ↑
↑
![]()
V(浓) = 0.0054L =5.4 mL
故答案为5.4mL;
⑶![]()
_1_K2Cr2O7+_14_HCl=_2_KCl+_2_CrCl3+_3_Cl2 +_7_H2O
化合价降低的为氧化剂即K2Cr2O7,化合价升高得到的产物为氧化产物即Cl2,上述反应中物质氧化性:K2Cr2O7 > Cl2,根据反应每1 mol K2Cr2O7反应转移6 mol电子生成3 mol Cl2,每生成lmol Cl2时有2mol电子即2NA电子发生转移,还原剂是HCl,参与反应的有14 mol,但化合价升高的只有6 mol,因此氧化剂与还原剂的物质的量之比为1:6,
故答案为1K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2;K2Cr2O7;Cl2;1.204×1024或2NA;1:6。


科目:高中化学 来源: 题型:
【题目】氯离子插层镁铝水滑石![]() 是一种新型离子交换材料,其在高温下完全分解为
是一种新型离子交换材料,其在高温下完全分解为![]() 、
、![]() 、
、![]() 和水蒸气,现用如图装置进行实验确定其化学式(固定装置略去)。
和水蒸气,现用如图装置进行实验确定其化学式(固定装置略去)。
(1)![]() 热分解的化学方程式为______________________。
热分解的化学方程式为______________________。
(2)若只通过测定装置C、D的增重来确定![]() ,则装置的连接顺序为_____________按气流方向,用接口字母表示),其中C的作用是________________。
,则装置的连接顺序为_____________按气流方向,用接口字母表示),其中C的作用是________________。
(3)加热前先通过![]() 排尽装置中的空气,称取C、D的初始质量后,再持续通入
排尽装置中的空气,称取C、D的初始质量后,再持续通入![]() 的作用是将分解产生的气体全部带入装置C、D中完全吸收、_____________等。
的作用是将分解产生的气体全部带入装置C、D中完全吸收、_____________等。
(4)完全分解后测得C增重3.65g 、D增重9.90g ,则![]() =_____________,若取消冷却玻管B后进行试验,测定
=_____________,若取消冷却玻管B后进行试验,测定![]() 值将______________(填“偏高”或“偏低”)。
值将______________(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A. 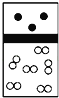 B.
B. 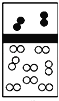 C.
C. 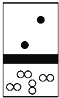 D.
D. 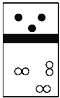
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用化学用语表示9个质子,10个中子的核素:___。
(2)写出下列反应方程式
①足量的NaOH溶液与SO2反应___。
②用氯气制备漂白粉的反应____。
(3)下列物质能导电的是___,属于电解质的是___,属于非电解质的是___(填序号)。
①NaCl溶液 ②干冰 ③液态氢化氢 ④铁 ⑤硫酸钡固体 ⑥蔗糖(C12H22O11) ⑦氨气 ⑧硫酸氢钠固体
写出⑧在水溶液中的电离方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(1)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(1) ΔH3 = –44.0 kJ·mol– 1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________________。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g)![]() CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl _______P2;A、B、C三点处对应平衡常数(KA、KB、KC)的由大到小的顺序为__________。(填“<”、“>”“=”)
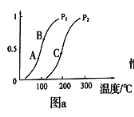
②100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,如果5min达到平衡时CH4的转化率为0.5,则v(H2)=________________100℃时该反应的平衡常数K =_________。反应达到平衡的标志是:_____________。
A.容器内气体密度恒定
B.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C.容器的压强恒定
D.3v正(CH4)= v逆(H2)
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度 B.缩小容器体积 C.再充入CH4气体 D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电致变色玻璃以其优异的性能将成为市场的新宠。如图所示为五层膜的玻璃电致变色系统,其工作原理是:在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是

A. 当B外接电源负极时,膜由无色变为蓝色
B. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
C. 当A接电源的负极时,此时Li+得到电子被还原
D. 当A接电源正极时,膜的透射率降低,可以有效阻挡阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图:
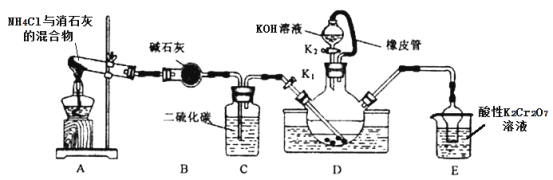
已知:①CS2不溶于水,比水重;NH3不溶于CS2;②三颈烧瓶内盛放有CS2、水和催化剂。
实验步骤如下:
(1)制备NH4SCN溶液:CS2+3NH3![]() NH4SCN+ NH4HS(该反应比较缓慢)
NH4SCN+ NH4HS(该反应比较缓慢)
①实验前,经检验装置的气密性良好。三颈烧瓶的下层CS2液体必须浸没导气管口,目的是_____。
②实验开始时打开K1,加热装置A、D,使A中产生的气体缓缓通入D中,至CS2消失。
则:装置A中反应的化学方程式是_____;装置C的作用是______。
(2)制备KSCN溶液:熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS= H2S↑ + 3NH3↑),打开K2,再缓缓滴加入适量的KOH溶液,发生反应:NH4SCN + KOH= KSCN + NH3↑ +H2O。
小组讨论后认为:实验中滴加入相同浓度的K2CO3溶液比KOH溶液更好,理由是_____。
(3)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶______,干燥,得到硫氰化钾晶体。
(4)测定晶体中KSCN的含量:称取10.0g样品配成1000mL溶液量取20.00mL于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液做指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN- + Ag+= AgSCN↓(白色)。则判断达到终点时的方法是____。
②晶体中KSCN的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的氢气在氯气中燃烧,所得混合物用100mL质量分数为20%,密度为1.2g/cm3的NaOH溶液吸收,恰好完全吸收,测得溶液中含有NaClO的物质的量为0.1mol。
(1)原NaOH溶液的物质的量浓度为___mol/L;
(2)所得溶液中Cl-的物质的量为___mol;
(3)原混合气体中氯气和氢气的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,不溶于水)主要适用于不透明的聚氯乙烯硬质管、注射成型制品,也可用于人造革等软质制品。以铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示。

已知:Ksp(PbSO4)=1.82×10-8,Ksp (PbCO3)=1.46×10-13
请回答下列问题:
(1)加入碳酸钠溶液后PbSO4转化为PbCO3。转化的方程式为:PbSO4(s)+CO32-(aq)=PbCO3(s)+SO42-(aq),通过计算(保留2位有效数字)说明该反应程度很大的原因:___________。这一步骤中,也可以将碳酸钠溶液改为碳酸氢钠溶液,写出用碳酸氢钠溶液时的离子方程式:___________。
(2)根据图溶解度曲线(g/100g水),由滤液I得到Na2SO4固体的操作为将“滤液1”___________、___________、用乙醇洗涤后于燥。

(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是___________(任意写出一条),生成NO的离子方程式:___________。
(4)“滤液2”中可循环利用的溶质为___________(填化学式)。
步骤④“沉铅”时若将Pb(NO3)2溶液与0.02mol·L-1的H2SO4等体积混合生成PbSO4沉淀时,所需Pb(NO3)2溶液的最小物质的量浓度为___________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com