
 草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100mL水溶液.量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定,所发生的反应:KMnO4+H2C2O4+H2SO4=K2SO4+CO2↑+MnSO4+H2O
草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值,进行如下实验:称取Wg草酸晶体,配成100mL水溶液.量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol•L-1的KMnO4溶液滴定,所发生的反应:KMnO4+H2C2O4+H2SO4=K2SO4+CO2↑+MnSO4+H2O分析 (1)KMnO4溶液具有强氧化性,能够腐蚀橡皮管,不能装在酸碱式滴定管中,只能用酸式滴定管;
(2)KMnO4溶液本身是紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,说明滴定到终点;
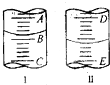
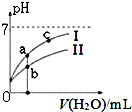
(3)图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,则B的刻度为20,所以量筒中液体的体积读数为22mL,在滴定管的下端有一段没有刻度,且0刻度在上面,所以液面处的读数是a时,滴定管中液体的体积大于(25-a)mL;
(4)根据化学方程式中各物质的关系进行计算出草酸的浓度,并根据Wg草酸晶体中草酸与结晶水的质量比可计算出x的值.
解答 解:(1)KMnO4溶液具有强氧化性,能够腐蚀橡皮管,不能装在酸碱式滴定管中,只能用酸式滴定管,
故答案为:酸;
(2)KMnO4溶液本身是紫色,所以在滴定草酸时不需要用指示剂,确定反应达到滴定终点时的现象是:滴入最后一滴KMnO4溶液,溶液由无色变红色(紫红色),且半分钟不褪色,
故答案为:不需要;滴入最后一滴KMnO4溶液,溶液由无色变红色(紫红色),且半分钟不褪色;
(3)图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,则B的刻度为20.0mL,所以量筒中液体的体积读数为22.0mL,在滴定管的下端有一段没有刻度,且0刻度在上面,所以液面处的读数是a时,滴定管中液体的体积大于(25-a)mL,故选D,
故答案为:22.0; D;
(4)2KMnO4~5H2C2O4
2 5
aV×10-3mol 0.025×cmol
c=$\frac{5aV×10{\;}^{-3}mol}{2×0.025mol}$=0.1aVmol•L-1,
样品中含有草酸的质量为:90g/mol×0.1aVmol/L×0.025L×4=0.9aVg,Wg草酸晶体中含有结晶水的质量为:Wg-0.9aVg,
草酸晶体中含有结晶水数目为:x=$\frac{\frac{Wg-0.9aVg}{18g/mol}}{\frac{0.9aVg}{90g/mol}}$=$\frac{50W}{9aV}$-5,
故答案为:0.1aV;$\frac{50W}{9aV}$-5.
点评 本题考查一定物质的量浓度溶液配制、滴定操作中仪器的选用及计算等,题目难度中等,注意掌握配制一定物质的量浓度的溶液即中和滴定操作的方法,能够根据实验原理进行计算.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
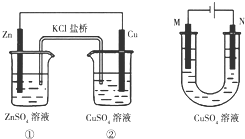
| A. | 装置①将电能转变为化学能 | |
| B. | 装置①中盐桥内的Cl-移向ZnSO4溶液 | |
| C. | 若装置②用于铁棒镀铜,则N极为铁棒 | |
| D. | 若装置②用于电解精炼铜,则溶液中的Cu2+浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
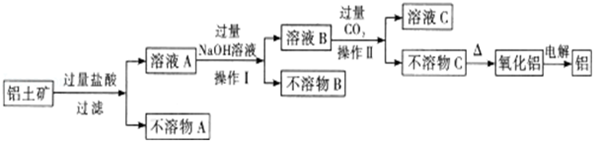
 “8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.
“8.12”天津港爆炸中有一定量的氰化物泄露.氰化物多数易溶于水,有剧毒,易造成水污染.为了增加对氰化物的了解,同学们查找资料进行学习和探究.| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 他们的组成元素是相同的 | |
| B. | 耐腐蚀的性能不同 | |
| C. | 它们都属于钢,因此物理性质相同 | |
| D. | 构成普通钢和不锈钢的主要元素都是铁,因此它们的化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com