
有一支50 mL酸式滴定管中盛有盐酸,液面恰好在a mL刻度处,把管内液体全部放出,盛量筒内,所得液体体积一定是( )
A.a mL B.(50-a) mL C.大于(50-a) mL D.大于a mL
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:填空题
己知某烷烃分子中电子数为42。
(1)该烷烃的分子式为______________。
(2)写出该烷烃分子的所有同分异构体的结构简式________________。
(3)上述同分异构体中,在相同条件下沸点最低的是___________。(写结构简式)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
某温度下,相同pH的硫酸和硫酸铝溶液中由水电离出的c(H+)分别是1.0×l0-10 mol•L-1和1.0×10-3 mol•L-1,则此温度下水的离子积Kw为( )
A.1.0×l0-15 B.1.0×10-14 C.1.0×10-13 D.1.0×l0-7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
向100 mL pH = l的H2SO4溶液中,滴加0.01 mol•L-1 NaOH溶液,当所得混合液的pH为2时,加入NaOH溶液的体积是( )
A.10 mL B.90 mL C.100 mL D.450 mL
查看答案和解析>>
科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:简答题
(14分)发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
(1)将煤转化成水煤气的反应:C(s)+H2O(g) CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。
CO(g)+H2(g)可有效提高能源利用率,若在上述反应体系中加入催化剂(其他条件保持不变),此反应的△H________(填“增大”、“减小”或“不变”),判断的理由是________。
(2)CO2制备甲醇:CO2(g)+3H2(g)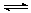 CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。
CH3OH(g)+H2O(g)ΔH=-49.0kJ·mol-1,在体积为1L的密闭容器中,充入1molCO2和3molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如右图所示。
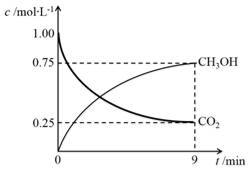
①该反应化学平衡常数K的表达式是________。
②0~9min时间内,该反应的平均反应速率ν(H2)=________。
③在相同条件下,密闭容器的体积缩小至0.5L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。
a.0<Q<29.5
B.29.5<Q<36.75
C.36.75<Q<49
D.49<Q<98
④在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如右图所示,L和X分别表示温度或压强。
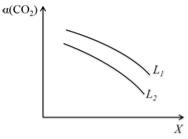
X表示的物理量是。判断L1与L2的大小关系。
(3)科学家用氮化镓材料与铜组装如右图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.

写出铜电极表面的电极反应式,为提高该人工光合系统的工作效率,可向装置中加入少量(选填“盐酸”或“硫酸”).
(4)利用CO2和NH3为原料也合成尿素,在合成塔中的主要反应可表示如下:
反应①:2NH3(g)+CO2(g)=NH2CO2NH4(s)△H1=__________________
反应②:NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1
总反应:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-86.98kJ·mol-1;
则反应①的△H1=_______________。
(5)现将amol铁和bmol铜的混合物与含有cmolHNO3的稀溶液充分反应,设还原产物为NO。下列结论不正确的是(填序号)
A.若剩余金属0.5amol,则氧化产物为一种或二种
B.若只有一种氧化产物,则3c=8a
C.若有二种氧化产物,被还原的硝酸物质的量为0.25cmol
D.若有三种氧化产物,被还原的硝酸物质的量为0.25cmol
查看答案和解析>>
科目:高中化学 来源:2017届江西省鹰潭市高三上学期第四次月考化学试卷 题型:选择题
将相同状况下的下列气体分别充满一干燥烧瓶中,把烧瓶倒置于水中,瓶内液面逐渐上升,假设烧瓶内溶液不扩散,则最终该溶液中溶质的物质的量浓度大小关系为
①NH3;②NO2;③体积比4:1混合的NO2和O2;④NO(用导管向烧瓶中缓缓通入O2至气体恰好完全吸收)
A.①=②>③>④
B.①=②=③=④
C.①=②=④>③
D.①>③>②>④
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)为6.0mol•L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
A.原混合溶液中c(K+)为4mol/L
B.电解后加入1molCu(OH)2可使溶液复原
C.电解后溶液中c(H+)为8mol/L
D.原溶液中c(Cu2+)为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com