
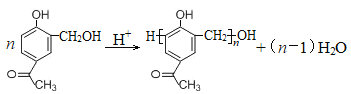
【题目】沙丁胺醇(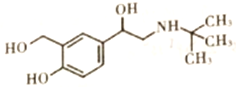 )是一种新型药物,常用于缓解哮喘等肺部疾病,其一种合成路线如下。
)是一种新型药物,常用于缓解哮喘等肺部疾病,其一种合成路线如下。
(1)沙丁胺醇的分子式为_____________,C中官能团的名称为_____________。
(2)①的反应类型为____________,⑥的反应类型为____________。
(3)B的结构简式为_____________。
(4)A在酸性条件下发生缩聚反应的化学方程式为__________________________。
(5)符合下列条件的B的同分异构体有________种(不考虑立体异构),其中任意一种的结构简式为_____________。
a.苯环上有两个取代基; b.能与NaHC03反应生成CO2。
(6)写出以苯酚、甲醛和乙酸酐(![]() )为原料制备高分子
)为原料制备高分子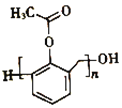 的合成路线:____________________________________________________(无机试剂任选)
的合成路线:____________________________________________________(无机试剂任选)
【答案】 C13H21NO3 酯基、羰基(或酮基) 加成反应 取代反应 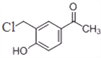
 18种
18种 ![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,再分别有邻位和间位,任写一种即可
,再分别有邻位和间位,任写一种即可 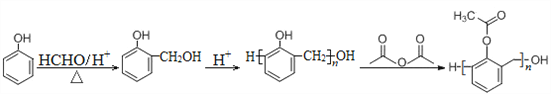
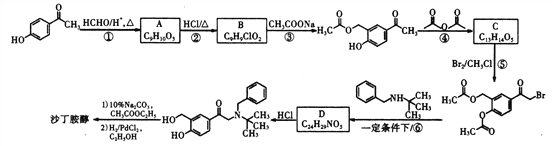
【解析】① 与甲醛加成生成A、
与甲醛加成生成A、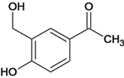 ,②A中醇中羟基与HCl发生取代反应生成B、
,②A中醇中羟基与HCl发生取代反应生成B、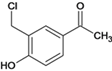 ,③B与乙酸钠发生取代反应生成
,③B与乙酸钠发生取代反应生成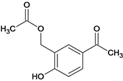 ,④再发生取代反应生成C、
,④再发生取代反应生成C、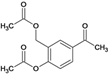 ,⑤C与溴发生取代反应生成
,⑤C与溴发生取代反应生成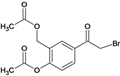 、⑥发生取代反应生成D、
、⑥发生取代反应生成D、 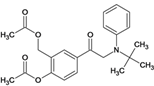 。
。
(1)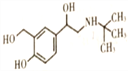 沙丁胺醇的分子式为C13H21NO3 ,C
沙丁胺醇的分子式为C13H21NO3 ,C 中官能团的名称为酯基、羰基(或酮基)。(2)①的反应类型为加成反应,⑥的反应类型为取代反应。(3)B的结构简式为
中官能团的名称为酯基、羰基(或酮基)。(2)①的反应类型为加成反应,⑥的反应类型为取代反应。(3)B的结构简式为 。(4)A在酸性条件下发生缩聚反应的化学方程式为
。(4)A在酸性条件下发生缩聚反应的化学方程式为 。(5)符合下列条件的B的同分异构体有18种 种(不考虑立体异构),其中任意一种的结构简式为
。(5)符合下列条件的B的同分异构体有18种 种(不考虑立体异构),其中任意一种的结构简式为 ![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,再分别有邻位和间位,任写一种即可。(6)写出以苯酚、甲醛和乙酸酐(
,再分别有邻位和间位,任写一种即可。(6)写出以苯酚、甲醛和乙酸酐(![]() )为原料制备高分子
)为原料制备高分子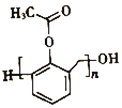 的合成路线:
的合成路线:


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】向铜屑、稀盐酸和铁盐的混合溶液中持续通入空气可制备氯化铜。其反应过程如图所示。

下列说法不正确的是
A. Fe3+对该反应有催化作用
B. 该过程中的Fe3+可由Fe(NO3)3提供
C. 可用K3[Fe(CN)6]溶液区分Fe3+与Fe2+
D. 制备CuCl2的总反应为2Cu + O2 + 4HCl = 2CuCl2 + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)将35.2铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为_____L,NO2的体积为______L。
(2)参加反应的硝酸的物质的量是_______mol。
(3)待产生的气体全部释放后,向溶液加入VmL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为___________mol/L。(结果不需化简)
(II)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为10 g,求
(1)此混合物中CO和CO2物质的量之比_____。
(2)CO的质量分数_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2—溴丙酸(CH3CHBrCOOH)是有机合成的重要中间体。实验室制备2—溴丙酸的反应(PCl3易潮解)、装置示意图(加热和夹持装置略去)和有关数据如下:CH3CH2COOH+Br2 → CH3CHBrCOOH+HBr
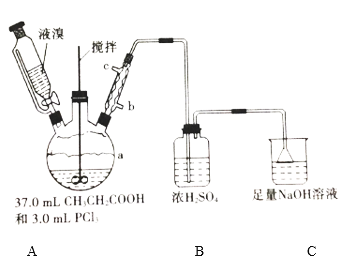
物质 | 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 |
Br2 | 160 | 3.1 | 58.8 | 微溶于水,易溶于有机 |
CH3CH2COOH | 74 | 0.99 | 141.1 | 易溶于水和有机溶剂 |
CH3CHBrCOOH | 153 | 1.7 | 203(分解) | 能溶于水和有机溶剂 |
请回答:
(1)检验a装置气密性的方法:盖紧滴液漏斗玻璃塞,_____________________,观察到导管口有气泡冒出,撤走热源后,导管中进入一段水柱,则证明气密性良好。
(2)按上图所示添加药品,先水浴加热a,再向a中滴加足量液溴,充分反应后,停止加热。
①a的容积最适合的是__________(填选项字母)
A.50 mL B.100 mL C.250 mL D.500 mL
②冷凝管的出水口为__________(填“b”或“c”)。
③C装置的作用为________________________________________。
(3)冷却至室温后,将a中液体减压蒸馏、纯化,收集得27.0 mL CH3CHBrCOOH。
①采用减压蒸馏的原因为_______________________________________。
②本实验的产率为_________。
(4)欲用上述装置验证a中发生取代反应,需更换B、C中的试剂。则C中应加入的试剂为____________;装置B的作用为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月5日,中国国产大飞机C919首飞成功。为了减轻机身重量,飞机某些部件使用了镁合金。
(1)基态镁原子核外电子的轨道表达式为___________,其核外有_________种能量不同的电子。
(2)①第二电离能:Na_______Mg(填“>”“<”或“=”),其原因为______________。
②热稳定性:CaCO3>MgCO3,其原因为___________________________。
(3)镁不仅在工业生产中用途广泛,也是动植物生命活动中必不可少的微量元素,下图为叶绿素的结构示意图。

①图中与Mg形成配位键的N原子的标号为________(填写“Ⅰ”“Ⅱ”“Ⅲ”“Ⅳ”)。
②叶绿素中,碳原子的杂化形式为________。
(4)碳化镁是一种在化工行业用途广泛的金属碳化物,某种碳化镁的晶体结构如图1所示,图2为其俯视图。

①晶体中Mg的配位数为________。
②已知阿伏伽德罗常数的值为NA,据图1中计算该碳化镁的密度为________g·cm-3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有阳离子交换膜,阴离子交换膜、石墨电极和如图所示的电解槽。利用氯碱工业中的离子交换膜技术原理,可电解Na2SO4溶液生产NaOH溶液和H2SO4溶液。下列说法中正确的是
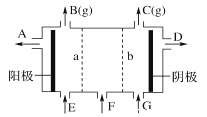
A. 阴极反应式为4OH--4e-=2H2O+O2↑ B. 从A口出来的是NaOH溶液
C. b是阳离子交换膜,允许Na+通过 D. Na2SO4溶液从G口加入
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③![]() ④CH≡CH ⑤NH3 ⑥CH4
④CH≡CH ⑤NH3 ⑥CH4
A. ①②③ B. ①⑤⑥ C. ②③④ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、O、Na、Mg、Al、S、Cl是常见的八种元素,根据元素及其化合物性质,回答下列问题:
(1)S在周期表中的位置为______;CO2的电子式是_______。
(2)比较O、Na元素常见离子的半径大小(用化学式表示,下同)____>____;__________比较S、Cl元素的最高价氧化物对应水化物的酸性强弱:____>____ 。_______________
(3)已知:
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是___________;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(4)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的结构简式为______;Q的化学式为_______ 。
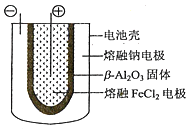
(5)熔融状态下,钠和FeCl2能组成可充电电池(装置示意图如下),反应原理为:2Na+FeCl2![]() Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
Fe+2NaCl.放电时,电池的正极反应式为___________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com