
| A. | 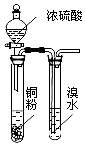 用图所示装置验证浓硫酸具有强氧化性 | |
| B. | 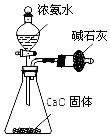 用图所示装罝制取干燥的 NH3 | |
| C. | 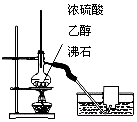 用图所示装置制取并收集乙烯 | |
| D. | 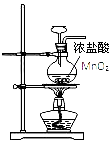 用图所示装置制取 Cl2 |
分析 A.浓硫酸和铜应在加热条件下反应;
B.CaO与反应放热,可促进氨气的挥发;
C.温度计位置错误;
D.氯气从长颈漏斗逸出.
解答 解:A.浓硫酸和铜在常温下不反应,应在加热条件下进行试验,故A错误;
B.CaO与反应放热,可促进氨气的挥发,可用于制备少量氨气,故B正确;
C.制备乙烯,应加热至170℃,温度计应插入液面以下,故C错误;
D.氯气从长颈漏斗逸出,应用分液漏斗,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、物质的制备实验等,把握物质的性质、反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 聚氯乙烯塑料广泛应用于塑料薄膜、食品包装袋等 | |
| C. | 高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 氢氧燃料电池、硅太阳能电池都利用了原电池原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B |  | 反应结束后,锥形瓶中溶液的溶质是Cu(NO3)2、CuSO4,集气瓶中收集到的气体是NO |
| C | 向1mL浓度均为0.05mol•L-l NaCl、NaI的混合溶液中滴加2滴0.01mol•L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp (AgCl)>Ksp(AgI) |
| D | 室温下,用pH试纸测得0.1mol•L-1 NaHSO3溶液的pH约为5 | HSO3-的电离程度大于其水解程度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X的最高价含氧酸为强酸,则X的氢化物溶于水一定显酸性 | |
| B. | 若Y的最高正价为+m,则X的最高正价一定为+m | |
| C. | 若X元素形成的单质是X2,则Y形成的单质一定是Y2 | |
| D. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 维生素C具有较强还原性,高温烹饪蔬菜会损失维生素C | |
| B. | 玉米油和鸡蛋清均是高分子化合物,它们均能水解生成氨基酸 | |
| C. | 通过电镀工业可制备铅笔芯,铅笔芯含有大量的铅因此可以导电 | |
| D. | 在水泥路面翻晒的粮食,易受四氯化碳和甲醛等有害物质污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向汽油中添加甲醇后,该混合燃料的热值不变 | |
| B. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| C. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| D. | 某种光学检测技术具有极高的灵敏度,可检测到单个细胞(V≈10-12L)内的数个目标分子,据此可推算该检测技术能测量细胞内浓度约为10-12~10-11mol•L-1的目标分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性能将Fe氧化成Fe3+ |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 常温下分别测定浓度均为0.2mol/L的HClO溶液和0.1mol/LH2SO4溶液的pH | pH:HClO>H2SO4 | 非金属性:S>Cl |
| D | 向某溶液中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com