
 氮元素可以形成多种氢化物,如NH3、N2H4等.
氮元素可以形成多种氢化物,如NH3、N2H4等.| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
c(N
| ||
| c(NH3?H2O)?c(H +) |
| 1.26mol |
| 3mol |
| c(NH4+) |
| c(NH3?H2O)c(H+) |
| c(NH4+)c(OH-) |
| c(NH3?H2O)c(H+)c(OH-) |
| Ka |
| Kw |
| 10-5(10-5-10-9) |
| 2a-(10-5-10-9) |
| 1×10-10 |
| 2a-1×10-5 |
| 1×10-10 |
| 2a-1×10-5 |


科目:高中化学 来源: 题型:
| A、实验室用排饱和食盐水而不用排水法收集氯气 |
| B、加催化剂,使N2和H2在一定条件下转化为NH3 |
| C、N2和H2反应生成NH3,加压有利于提高 NH3的产率 |
| D、光照新制的氯水时,溶液中c(H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质的还原性:A>B>D>C |
| B、离子半径:C>D>B>A |
| C、原子序数:d>c>b>a |
| D、原子半径:A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的(已知,气压减小,水的沸点降低)( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的(已知,气压减小,水的沸点降低)( )| A、氢氧化钠溶液、二氧化碳 |
| B、盐酸、氨气 |
| C、氢氧化钠溶液、一氧化碳 |
| D、石灰水、二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 | 金属质量 /g | 金属 状态 | c(H2SO4) /mol?L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 2 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
查看答案和解析>>
科目:高中化学 来源: 题型:
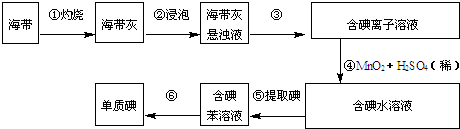
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)①如图,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为
(1)①如图,A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷与氢氧化钠水溶液共热 |
| B、溴乙烷与氢氧化钠的乙醇溶液共热 |
| C、苯与浓硝酸、浓硫酸制硝基苯 |
| D、乙炔与氯化氢在一定条件下制氯乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com