
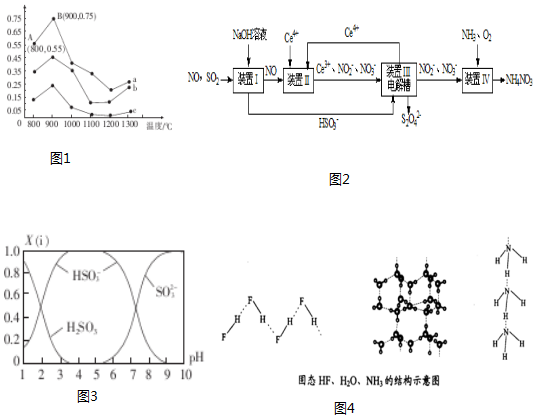
���� ��1��������a�У�NO����ʼŨ��Ϊ6��10-4mg/m3��A����ѳ���Ϊ55%��B����ѳ���Ϊ75%����A�㵽B�㾭��0.8 s����ʱ�����NO���ѳ�����=$\frac{һ����������ı仯}{�仯ʱ��}$��
��NH3��NO�����ʵ����ı�ֵԽ��NO�ѳ���Խ�������ʵ���֮�ȷֱ�Ϊ1��3��3��1��4��1ʱ����Ӧ������Ϊc��b��a��������b ��ӦNH3��NO�����ʵ���֮����3��1��
��2��NH3�ѳ�NO�Ļ�ѧ����ʽΪ4NH3��g��+6NO��g���T5N2��g��+6H2O��l�����ɽ�ϸ�˹���ɼ��㣻
��3���ٵ���Һ��pH=8ʱ������ͼʾ�õ���Һ���������ƺ����������ƵĻ�����������Ũ�ȴ�С�Ƚϵķ������ش�
��NaHSO3��Һ��HSO3-�ĵ������ˮ�⣬��Һ��ʾ���ԣ�����ƽ���ƶ�ԭ�����ش�
��4�������Ի����£�NO��Ce4+֮��ᷢ��������ԭ��Ӧ��
��� �⣺��1��������a�У�NO����ʼŨ��Ϊ6��10-4mg/m3��A����ѳ���Ϊ55%��B����ѳ���Ϊ75%����A�㵽B�㾭��0.8 s����ʱ�����NO���ѳ�����=$\frac{��75%-55%����6��1{0}^{-4}}{0.8s}$=1.5��10-4mg/��m3•s����
�ʴ�Ϊ��1.5��10-4��
��NH3��NO�����ʵ����ı�ֵԽ��NO�ѳ���Խ�������ʵ���֮�ȷֱ�Ϊ1��3��3��1��4��1ʱ����Ӧ������Ϊc��b��a��������b ��ӦNH3��NO�����ʵ���֮����3��1��
�ʴ�Ϊ��3��1��NH3��NO�����ʵ����ı�ֵԽ��NO�ѳ���Խ��
��2����֪��25�棬101kPaʱ��
��N2��g��+3H2��g���T2NH3��g����H=-Q1kJ/mol
��2H2��g��+O2��g���T2H2O��l����H=-Q2kJ/mol
��N2��g��+O2��g���T2NO��g����H=-Q3kJ/mol
���ø�˹���ɣ����ڡ�3-�١�2-�ۡ�3�ɵ�4NH3��g��+6NO��g���T5N2��g��+6H2O��l����H=-��3Q2+3Q3-2Q1�� kJ/mol��
�ʴ�Ϊ��4NH3��g��+6NO��g���T5N2��g��+6H2O��l����H=-��3Q2+3Q3-2Q1�� kJ/mol��
��3���ٵ���Һ��pH=8ʱ������ͼʾ�õ���Һ���������ƺ����������ƵĻ�������Ũ�ȴ�С˳���ǣ�c��Na+����c��SO32-����c��HSO3-����c��OH-����c��H+����
�ʴ�Ϊ��c��Na+����c��SO32-����c��HSO3-����c��OH-����c��H+����
��NaHSO3��Һ��HSO3-�ĵ������ˮ�⣬HSO3-?SO32-+H+����Һ��ʾ���ԣ�����CaCl2��Һ��Ca2++SO32-=CaSO3��ʹ����ƽ�����ƣ�
�ʴ�Ϊ��HSO3-����Һ�д��ڵ���ƽ�⣺HSO3-?SO32-+H+����CaCl2��Һ��Ca2++SO32-=CaSO3��ʹ����ƽ�����ƣ�c��H+������
��4�������Ի����£�NO��Ce4+֮��ᷢ��������ԭ��Ӧ��NO+H2O+Ce4+=Ce3++NO2-+2H+��
�ʴ�Ϊ��NO+2H2O+3Ce4+=3Ce3++NO3-+4H+��
���� ���⿼���˷�Ӧ���ʵļ��㡢�����������Ⱦ����������ѧƽ�⼰��Ӱ�졢������ԭ��Ӧ��֪ʶ����Ŀ�Ѷ��еȣ�����֪ʶ��϶ࡢ�ۺ��Խ�ǿ����ֿ���ѧ���ķ������������Ӧ�û���֪ʶ��������ע�����ջ�ѧƽ���ƶ�ԭ������Ӧ�ã��ܹ���ȷ��д�缫��Ӧʽ�����ӷ���ʽ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����ϩ ��CH3COOH ��CH3CH2OH ��CH2=CH-CH3 ��
����ϩ ��CH3COOH ��CH3CH2OH ��CH2=CH-CH3 ��
| A�� | �٢� | B�� | �٢ۢܢ� | C�� | �٢� | D�� | �٢ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��ϩ�Ʒӵķ���ʽΪC18H20O2 | |
| B�� | ��ϩ�Ʒ���NaOH��Һ��NaHCO3��Һ���ܷ�Ӧ | |
| C�� | 1mol��ϩ�Ʒ��������2mol Na������Ӧ | |
| D�� | ��ϩ�Ʒ��뱥����ˮ���Է����ӳɷ�Ӧ��ȡ����Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��2����5�� | B�� | ��1����3�� | C�� | ��1����5�� | D�� | ��2����3����4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4mol 35% | B�� | 2mol 30% | C�� | 2mol 70% | D�� | 1mol 15% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��� | �� | �� | �� | �� |
| V[FeCl3��aq��]/mL | 100 | 100 | 100 | 100 |
| ��Ϸ�ĩ����/g | 6 | 13.2 | 24 | 36 |
| ��Ӧ��ʣ���������/g | 0 | 1.28 | 12.8 | 24.8 |
| A�� | �ڢ�����Һ��c��Fe3+��=3.0 mol/L | |
| B�� | �ڢ���ʣ�������ͭ������� | |
| C�� | �ڢ��鷴Ӧ�����Һ��c��Fe2+��=6 mol/L | |
| D�� | ԭ��Ϸ�ĩ��n��Fe����n��Cu��=3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧ��������������������������ʱ���������ȷ�Ӧ | |
| B�� | ��Ҫ���Ȳ��ܽ��еĻ�ѧ��Ӧһ�������ȷ�Ӧ | |
| C�� | ��ѧ��Ӧ�е������仯�����������仯�⣬������ת��Ϊ���ܡ����ܵ� | |
| D�� | ��ѧ��Ӧ�����е������仯�����������غ㶨�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH2�TCH-CH�TCH2 1��3-����ϩ | B�� | CH3-O-CH3���� | ||
| C�� |  3-���� 3-���� | D�� |  2-������ 2-������ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com