
| A. | CH4O | B. | CH3CH2OH | C. |  | D. | 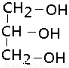 |
分析 根据n=$\frac{V}{{V}_{m}}$计算二氧化碳、氢气的物质的量,根据C原子守恒计算饱和醇分子中C原子数目,根据H原子守恒计算醇分子中-OH数目,可以且饱和醇的分子式,结合选项中结构简式判断.
解答 解:二氧化碳物质的量为$\frac{44.8L}{22.4L/mol}$=2mol,根据C原子守恒,可知饱和醇分子中C原子数目为$\frac{2mol}{1mol}$=2,与钠反应生成氢气为$\frac{22.4L}{22.4L/mol}$=1mol,根据H原子守恒,可知醇分子中-OH数目为$\frac{1mol×2}{1mol}$=2,故该饱和醇的结构简式为 ,故选C.
,故选C.
点评 本题考查有机物分子式与结构的确定,难度不大,注意对基础知识的理解掌握.


 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
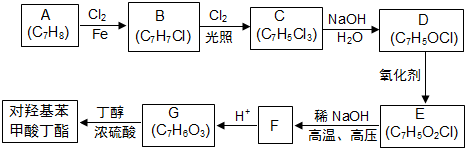
 ; F的分子式为C7H4O3Na2;
; F的分子式为C7H4O3Na2; ,该反应类型为取代反应;
,该反应类型为取代反应;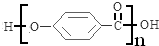 .
.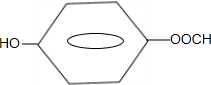 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.
“低碳循环”、如何降低大气中CO2的含量、有效地开发利用CO2,引起了全世界的普遍重视.| 实验组 | 温度/℃ | 起始量(mol) | 平衡量(mol) | 达到平衡所需要时间/min | ||
| CO(g) | H2O(g) | CO2(g) | H2(g) | |||
| I | 800 | 2 | 2 | x | 1 | 5 |
| II | 900 | 1 | 2 | 0.5 | 0.5 | tm |
| III | 900 | 2 | 4 | y | y | tn |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物不可以含共价键 | |
| B. | 含有共价键的化合物不一定是共价化合物,但是共价化合物只能含有共价键 | |
| C. | 共价化合物可以含离子键 | |
| D. | 离子键、共价键、金属键和氢键都是化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HCO3-+H2O?H3O++CO32- | B. | NH4++H2O?NH3•H2O+H+ | ||
| C. | PO43-+H2O═HPO42-+OH- | D. | NH3+H2O?NH4++OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com