
| A. | 与碱反应生成盐和水 | B. | 使紫色石蕊试液变蓝色 | ||
| C. | 与活泼金属反应生成盐和氢气 | D. | 与氧化钠反应生成盐和水 |
科目:高中化学 来源: 题型:实验题
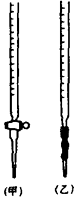 已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:
已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 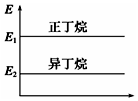 正丁烷与异丁烷的能量大小关系如图 | |
| B. | 正丁烷的稳定性大于异丁烷 | |
| C. | 异丁烷转化为正丁烷的过程是一个放热过程 | |
| D. | 异丁烷分子中的碳氢键比正丁烷的多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去乙烷中混有的乙烯 | 酸性高锰酸钾溶液洗气 | 乙烯与酸性高锰酸钾溶液反应而乙烷不能 |
| D | 除去乙酸乙酯中混有的乙酸 | 用饱和碳酸钠溶液洗涤后分液 | 乙酸能与碳酸钠反应生成溶于水的盐 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
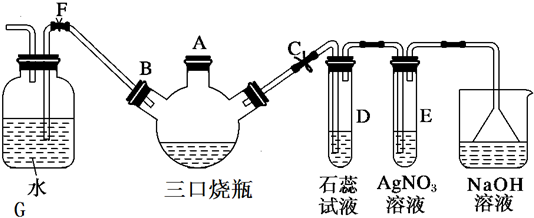

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
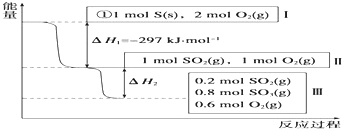
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
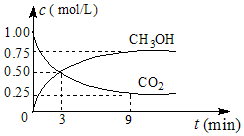
| A. | 用高效催化剂,可使CO2的平衡转化率增大 | |
| B. | 单位时间内消耗CO2和H2的物质的量比为1:3时,反应达到平衡 | |
| C. | 及时分离出CH3OH和H2O可提高CO2和H2的转化率 | |
| D. | 升高温度可使该反应向正反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com