
【题目】通过计算回答下列问题:
(1)完全燃烧0.1mol某烃,燃烧产物依次通过浓硫酸、浓碱溶液,实验结束后,称得浓硫酸质量增加9g,浓碱溶液质量增加17.6g。该烃的化学式为_____,并写出其所有可能的结构简式:____。
(2)某链状烷烃的相对分子质量为128,该烷烃的化学式为_________。
【答案】C4H10 CH3CH2CH2CH3、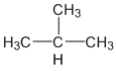 C9H20
C9H20
【解析】
(1) 浓硫酸质量增加9g为某烃燃烧产生的水质量,浓碱溶液质量增加17.6g为二氧化碳质量,由此计算0.1mol某烃中C、H的物质的量;
(2)由烷烃的通式,可用相对分子质量来计算C的个数,从而得到分子式。
(1)浓硫酸质量增加9g为某烃燃烧产生的水质量,浓碱溶液质量增加17.6g为二氧化碳质量,0.1mol烃中含有碳原子的物质的量为:![]() ,含有氢原子的物质的量为
,含有氢原子的物质的量为![]() ,则每个烃分子含有4个碳原子,10个氢原子,分子式为C4H10,可能的结构简式为:CH3CH2CH2CH3、
,则每个烃分子含有4个碳原子,10个氢原子,分子式为C4H10,可能的结构简式为:CH3CH2CH2CH3、 ,故答案为:C4H10;CH3CH2CH2CH3、
,故答案为:C4H10;CH3CH2CH2CH3、 ;
;
(2)烷烃组成的通式为CnH2n+2,其相对分子质量为128,故12n+2n+2=128,解得n=9,则分子式为C9H20,故答案为:C9H20。


科目:高中化学 来源: 题型:
【题目】下图为海水利用的部分过程。下列有关说法正确的是
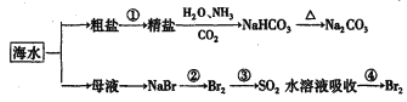
A. 粗盐提取精盐的过程只发生物理变化
B. 用澄清的石灰水可鉴别Na2CO3产品是否含有NaHCO3
C. 在第②、④步骤中,溴元素均被还原
D. 制取NaHCO3的反应是利用其溶解度小于NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
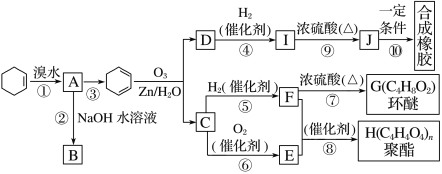
【题目】环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中F可以作内燃机的抗冻剂,J分子中无饱和碳原子。
已知:R1—CH===CH—R2![]() R1—CHO+R2—CHO
R1—CHO+R2—CHO
(1)③的反应条件是_________________________________________________。
(2)A的名称是_______________________________________________。
(3)有机物B和I的关系为________(填字母)。
A.同系物 B.同分异构体
C.都属于醇类 D.都属于烃
(4)①~⑩中属于取代反应的________________________________________。
(5)写出反应⑩的化学方程式____________________________________。
(6)写出两种D的属于酯类的链状同分异构体的结构简式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL0.2mol·L-1的KIO3溶液中逐渐加入NaHSO3粉末,生成的I2的物质的量随所加NaHSO3的物质的量变化如图所示,下列说法不正确的是( )

A.A点对应的I2的物质的量为1.0×10-3mol
B.0a:ab=5:1
C.当溶液中的n(I2)=5×10-4mol时,加入NaHSO3的物质的量可能为2.5×10-3mol或4.5×10-3mol
D.由ab段反应可知,氧化性I2>HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下,下列说法不正确的是
![]()
A.若A为硝酸,X为金属元素,则甲与丙反应可生成乙
B.若乙为NaHCO3,则丙一定是CO2
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和五氧化二钒在工业应用中广泛,某工厂从钒渣中回收金属,钒渣中主要成分有V2O3、FeO,还含有少量的CuO、Al2O3,工艺流程如图:
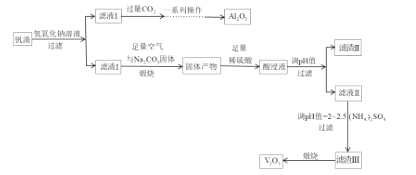
已知:①KspCu(OH)2=1.0×1021;KspFe(OH)3=4.0×1038;KspFe(OH)2=8.0×1016。
②NH4VO3难溶于水,(VO2)2SO4易溶于水。
(1)写出滤液I中加入过量的CO2时发生反应的离子方程式;制取纯净的Al2O3需要经过一系列操作:过滤、___、___。
(2)煅烧时,滤渣I的主要成分V2O3转化为可溶性NaVO3,写出其反应的化学方程式___。
(3)加入稀硫酸后,酸浸液中VO3与VO2+能大量共存的原因是___(用离子方程式解释)。
(4)常温下调节酸浸液的pH=___,即可以完全除去铁、铜两种元素对应的离子___;实际pH值要调整到8,其目的是___;调pH=2~2.5后过滤,滤渣III的主要成分为___。
(5)请写出煅烧滤渣III时,发生反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一。如图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。

(1)上述流程中,为加快化学反应速率而采取的措施是_____。
(2)过程Ⅰ中,过氧化氢在酸性条件下将Cu溶解,该反应的离子方程式是_____。
(3)过程Ⅱ中加入过量铁粉的目的是_____,该过程中用到的分离操作是_____。
(4)过程Ⅲ中,发生反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池的发明,是贮能和供能技术的巨大进步。
(1)如图所示装置中,Zn片是_____ (填“正极”或“负极”),Cu片上发生的电极反应为_____。

(2)该装置是典型的原电池装置,可将氧化还原反应释放的能量直接转变为电能,能证明产生电能的实验现象是_____。
(3)2019年诺贝尔化学奖授予对锂离子电池研究做出突出贡献的科学家。某锂离子电池的工作原理如图:

下列说法不正确的是_____(填序号)。
①A为电池的正极
②该装置实现了电能转化为化学能
③电池工作时,电池内部的锂离子定向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
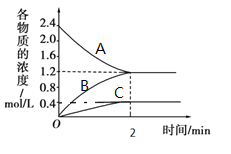
(1)该反应的化学方程式为__。
(2)从开始至2min,B的平均反应速率为__。
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号)__。
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗3nmolA,同时消耗nmol的B
D.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(4)在某一时刻采取下列措施能使该反应速率减小的是___。
A.加催化剂
B.降低温度
C.体积不变,充入A
D.体积不变,从容器中分离出A
(5)改变影响平衡的一个条件,5分钟后又建立了新平衡,发现C占平衡混合气的体积分数为![]() ,则反应物A的分解率为___。
,则反应物A的分解率为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com