
【题目】下列每组物质中化学键类型和分子的极性都相同的是
A. H2O和CS2 B. SO2和CO2 C. CO2和CH4 D. H2S和H2
科目:高中化学 来源: 题型:
【题目】某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度。实验步骤:①配制500mL浓度约为0.1 mol·L-1的NaOH溶液;②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度;③用已知准确浓度的NaOH溶液测定醋酸的浓度。
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解。该配制步骤 (填“可行”或“不可行”)。
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期 (填“小”或“大”),这是不能直接配制其标准溶液的原因。
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为 mol·L-1,滴定前将白醋稀释 (填“10”或“100”)倍。(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、 。
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至 即为终点。重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c mol·L-1)。
(6)原白醋中醋酸的物质的量浓度= mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2(g) + B2(g)=2AB(g) 的能量变化如图所示,下列叙述中正确的是( )
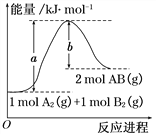
A. 每生成2mol AB(g) 共吸收b kJ热量
B. 该反应热ΔH = +(a-b) kJ·mol-1
C. 反应物的总能量大于生成物的总能量
D. 断裂1 mol A—A键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水中放入高锰酸钾晶体后,可以清楚地看到,溶液中紫红色范围逐渐扩大,最后整个溶液都变成紫红色,原因是( )
A.钾离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散
B.高锰酸根离子受到钾离子的作用,克服了离子间的斥力,逐渐向水中扩散
C.高锰酸根离子受到水分子的作用,克服了离子间的引力,逐渐向水中扩散
D.高锰酸钾是强氧化剂,水被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)要配制上述溶液,需用 量取12.5 mol/L的浓盐酸 mL。
(2)配制过程中,除(1)中所选仪器、以及烧杯、玻璃棒、胶头滴管外,还需用到的仪器有 。
(3)A、B是配制溶液时可能用到的二种仪器的一部分,请根据提供的情景按要求回答问题。

若按B中视线观察液面,则还需要继续进行的操作是 ;此操作完毕时,配制溶液的浓度 (填偏高、偏低、相符)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)=2H2(g)+O2(g) △H=+571.6 kJ/mol
B. 反应物的总能量低于生成物的总能量时,该反应为放热反应
C. 由石墨比金刚石稳定可知:c(金刚石,s)=c(石墨,s) △H<0
D. 已知:298K时,N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
2NH3(g) △H=-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5mol H2,达到平衡时放出46.0 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Al和不同的铜盐溶液间的反应为实验对象,探索Al与不同铜盐溶液反应的多样性。
实验 | 向试管中加入2ml溶液 | 实验现象 |
| 实验Ⅰ:0.5mol/LCuCl2溶液 | 15s:大量气泡且有红色物质析出 60s:反应进一步加快且反应剧烈放热,液体几乎沸腾 120s:铝片反应完,试管中析出大量蓬松的红色物质 |
实验Ⅱ:0.5mol/LCuSO4溶液 | 15s 无明显现象 60s:铝片表面有极少气泡 120s:有少量气泡溢出,铝片边缘有很少红色物质生成 |
(1)对实验Ⅰ进行研究②④
①实验Ⅰ中生成红色物质的离子方程式为:____________________________
经检验实验Ⅰ中产生的气体为氢气,用离子方程式解释溶液中存在H+的原因:_____________________
③请写出60s后反应进一步加快可能的原因(写出两条)_____________________________
(2)对实验Ⅱ进行研究
实验Ⅱ反应明显比实验Ⅰ缓慢,说明Al与不同的铜盐溶液反应呈现多样性,其原因可能有:
假设一:SO42-对Al与Cu2+的置换反应存在一定的抑制作用。
假设二:________________________
(3)为进一步研究上述假设,设计如下实验:
实验 | 向试管中加入2mL溶液 | 实验现象 |
| 实验Ⅲ:0.5mol/LCuCl2溶液+1g Na2SO4固体 | 加入 Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 |
实验Ⅳ:0.5mol/L CuCl2溶液+5g Na2SO4固体 | 加入Na2SO4固体后速率几乎不变,仍有大量气泡产生,红色物质生成且剧烈放热,铝片反应完全,溶液沸腾 | |
实验Ⅴ:0.5mol/LCuSO4溶液+0.02mol NaCl固体 | 未加入 NaCl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 | |
实验Ⅵ:0.5mol/LCuSO4溶液+_________ NH4Cl固体 | 未加入 NH4Cl固体前几乎没现象,加入后,铝片表面迅速产生大量气体和红色物质,溶液温度上升至沸腾,铝反应完全 |
_____________________________________
其中,实验Ⅰ与实验Ⅲ、Ⅳ做对比,结论为:______________________________________
其中,实验Ⅱ与实验Ⅴ、Ⅵ做对比,结论为:______________________________________
(4)请设计实验证明Cl-对Al与H+的反应同样起到相似的作用:_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com