
 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.分析 (1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
结合盖斯定律可知$\frac{①+②}{2}$得到CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);
(2)①若用甲醚作为燃料电池的原料,在碱性介质中电池负极上甲醚失去电子生成碳酸根离子;
②由电子守恒可知,CH3OCH3~12e-~6Cu;
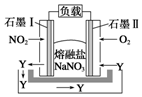
(3)由图可知,通入氧气的一端为正极,石墨I电极反应生成一种氧化物Y,可知NO2失去电子生成N2O5.
解答 解:(1)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
结合盖斯定律可知$\frac{①+②}{2}$得到CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g),△H=$\frac{-574kJ/mol-1160kJ/mol}{2}$=-867 kJ•mol-1,
则CH4(g)将NO2(g)还原为N2(g)的热化学方程式为CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1,
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1;
(2)①若用甲醚作为燃料电池的原料,在碱性介质中电池负极上甲醚失去电子生成碳酸根离子,电极反应为CH3OCH3-12e-+16OH-=2CO32-+11H2O,
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
②由电子守恒可知,CH3OCH3~12e-~6Cu,则通电30s后理论上在阴极可析出金属Cu为$\frac{1.12L/min×0.5min}{22.4L/mol}$×6×64g/mol=9.6g,
故答案为:9.6;
(3)由图可知,通入氧气的一端为正极,石墨I电极反应生成一种氧化物Y,可知NO2失去电子生成N2O5,则I上电极反应为NO2+NO3--e-=N2O5,
故答案为:NO2+NO3--e-=N2O5.
点评 本题考查热化学方程式及原电池,为高频考点,把握盖斯定律的应用、电极反应的书写为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:解答题
 氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一,消除氮氧化物有多种方法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯与钠形成离子键,氯与硅形成共价键 | |
| B. | 向淀粉KI溶液中滴加溴水,溶液变蓝 | |
| C. | 向Na2SO3溶液中滴加盐酸,有气泡生成 | |
| D. | F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: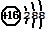 | |
| B. | 过氧化氢的电子式: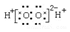 | |
| C. | Ge原子的简化电子排布式:[Ar]4s24p2 | |
| D. | 氯化钠的分子式:NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com