
| A. | 滴定终点时,溶液变为红色 | |
| B. | 该滴定法需在碱性条件下进行 | |
| C. | AgBr(s)+SCN-?AgSCN(s)+Br-(aq)的平衡常数K=0.77 | |
| D. | 该水样中溴离子浓度为:c(Br-)=$\frac{({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{25.00}$mol/L |
分析 根据实验步骤:①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2,②加入V1mL c1mol/LAgNO3溶液(过量),充分摇匀,反应形成AgBr沉淀,留有过量的Ag+,③用c2mol/LKSCN标准溶液进行滴定,反应产生AgSCN,至终点时消耗标准溶液V2mL,当达到滴定终点时,形成Fe(NCS)2+,溶液变成红色,指示终点到来.
原理就是加入硝酸银溶液时,溶液中产生了AgBr和过量的Ag+,接着用KSCN滴定溶液中过量的Ag+,当达到滴定终点时,产生Fe(NCS)2+,溶液呈红色,整个过程采用的是返滴定法.
解答 解:A.滴定终点时,生成Fe(NCS)2+,溶液呈红色,指示终点的到来,故A正确;
B.溶液中采用的是硝酸银溶液,KSCN溶液和铁铵矾为指示剂,溶液需保持在酸性条件下进行,故B错误;
C.反应为AgBr(s)+SCN-?AgSCN(s)+Br-(aq),根据多重平衡规则,反应的平衡常数为K=$\frac{c(B{r}^{-})}{c(SC{N}^{-})}$=$\frac{c(B{r}^{-})}{c(SC{N}^{-})}•\frac{c(A{g}^{+})}{c(A{g}^{+})}$=$\frac{{K}_{sp}(AgBr)}{{K}_{sp}(AgSCN)}$=$\frac{7.7×1{0}^{-13}}{1×1{0}^{-12}}$=0.77,故C正确;
D.采用返滴定法测定溶液中溴离子浓度,根据反应方程式,滴定溴离子所需的Ag+的物质的量为${(c}_{1}{V}_{1}-{c}_{2}{V}_{2})×1{0}^{-3}mol$,则水样中,c(Br-)=$\frac{({c}_{1}{V}_{1}-{c}_{2}{V}_{2})×1{0}^{-3}mol}{25.00×1{0}^{-3}L}$=$\frac{{c}_{1}{V}_{1}-{c}_{2}{V}_{2}}{25.00}mol/L$,故D正确.
故选B.
点评 本题考查沉淀溶解平衡,滴定原理的知识,需仔细阅读实验步骤,弄清实验原理.值得一提的是,本题采用的滴定方法是返滴定法,采用的是铁铵矾为指示剂,以KSCN返滴定测定溶液中卤素离子的含量,该法在大学分析化学中称为佛尔哈德法,要求溶液必须保持在酸性条件下.题目难度中等,是中档题.


科目:高中化学 来源: 题型:填空题
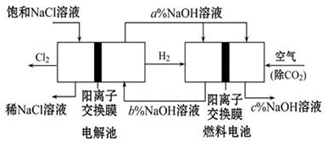
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键不是化学键 | |
| B. | 非极性共价键只能存在于单质中 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配位体是 Cl-和 H2 O,配位数是8 | |
| B. | 中心离子是 Ti4+,配离子是[TiCl(H2 O)5]2+ | |
| C. | 内界和外界中的 Cl-的数目比是 1:2 | |
| D. | 在 1mol 该配合物中加入足量 AgNO3 溶液,可以得到 3molAgCl 沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法不正确的是( )| A. | 该装置将化学能转化为电能 | |
| B. | 为了增加灯泡亮度,可以将电极碳棒变得多粗糙多孔 | |
| C. | 电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极a | |
| D. | 该电池的总反应:2H2+O2═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖 | B. | 乙酸 | C. | 蛋白质 | D. | 脂肪 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com