
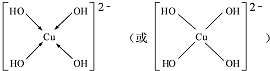
 .(用→标出配位键)1mol[Cu (OH)4]2-中有8mol σ键.
.(用→标出配位键)1mol[Cu (OH)4]2-中有8mol σ键. 分析 (1)①Mn的原子序数为25,根据能量最低原理可写出Mn的基态原子的电子排布式,进而可确定Mn2+基态的电子排布式;
②同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,据此判断第一电离能大小顺序;
(2)①周期表分为s区、p区、d区、ds区、f区,根据Cu的外围电子排布式分析;
②根据N2与CO为等电子体,结合等电子体结构相似判断;
③双键含有1个σ键和1个π键,CO2中含有2个双键;
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,配位键和O-H键都属于σ键.
解答 解:(1)①Mn的原子序数为25,基态原子的电子排布式为,1s22s22p63s23p63d54s2,则Mn2+基态的电子排布式可表示为1s22s22p63s23p63d5(或[Ar]3d5),
故答案为:1s22s22p63s23p63d5(或[Ar]3d5);
②同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>O>C,
故答案为:N>O>C;
(2)①Cu元素原子核外电子数为29,其基态原子的电子排布式为1s22s22p63s23p63d104s1,周期表分为s区、p区、d区、ds区、f区,Cu的外围电子排布式为3d104s1,Cu属于第IB族元素,在周期表中位于ds区,
故答案为:ds;
②N2与CO为等电子体,二者结构相似,N2的结构为N≡N,则CO的结构为C≡O,
故答案为:C≡O;
③双键含有1个σ键和1个π键,CO2结构式为O=C=O,含有2个双键,则1mol CO2 中含有的π键数目为2×6.02×1023个(或2 mol),
故答案为:2×6.02×1023个(或2 mol);
(3)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,则[Cu(OH)4]2-的结构可用示意图表示为: ,配位键和O-H键都属于σ键,所以1mol[Cu (OH)4]2-中有8molσ键,
,配位键和O-H键都属于σ键,所以1mol[Cu (OH)4]2-中有8molσ键,
故答案为 ;8.
;8.
点评 本题综合考查物质的结构与性质知识,侧重于电子排布式、第一电离能、配位键等知识,题目难度中等,注意把握配位键的判断方法,试题知识点较多、综合性较强,充分考查了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和H2SO4 | B. | Na2SO3和盐酸 | C. | Na2S和HCl | D. | Na2SO3和H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 反应开始20 s内以二氧化氮表示的平均反应速率为0.00125 mol/L•s | |
| B. | 80 s时向容器中加入0.32 mol氦气,同时将容器扩大为 4 L,则平衡将不移动 | |
| C. | 当反应达到平衡后,若缩小容器的体积,平衡向生成N2O4方向移动,气体的颜色变深 | |
| D. | 若其它条件不变,起始投料改为0.40 mol N2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核内有2个质子 | B. | 与4He互为同位素 | ||
| C. | 核内有1个中子 | D. | 是4He的同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A原子最外层电子数比B原子的最外层电子数少 | |
| B. | 将A、B组成原电池时,A为正极 | |
| C. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 | |
| D. | 将A和B用导线相连接,一同放入CuSO4溶液中,B的表面有红色的铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
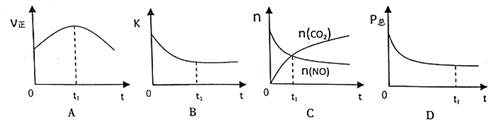
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(CO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正化合价:③>②>① | B. | 单质氧化性:③>①>② | ||
| C. | 电负性:③>②>① | D. | 原子半径:③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com